
Therapie der vaginalen Atrophie
Für die Therapie eignet sich vor allem eine lokale Estrogensubstitution, da diese niedriger dosiert erfolgen kann als eine orale Therapie und kaum mit systemischen Nebenwirkungen gerechnet werden muss. Aufgrund seiner physiologischen Eigenschaften kommt dem Estrogen Estriol für die vaginale Anwendung eine große Bedeutung zu.
Behebung des Estrogenmangels
Es ist naheliegend, dass im Vordergrund einer Therapie der urogenitalen Beschwerden die Beseitigung des Estrogendefizits steht. Eine Estrogenanwendung gilt daher als Standardtherapie1,2. Scheidentrockenheit kann zwar auch durch einfache Gleit- oder Befeuchtungsgele kurzfristig verbessert werden. Die effektivste Therapie ist jedoch die lokale Estrogenisierung1,3. Die lokale Behandlung der vaginalen Atrophie stellt eine risikoarme Option dar. Dies gilt insbesondere bei Verwendung „schwacher“ Estrogene wie Estriol in niedriger Dosierung4.
Urogenitale Probleme des Estrogenmangels sind eine Domäne der lokalen Behandlung, da der Therapieeffekt meist deutlicher ausgeprägt und die Akzeptanz oft größer ist als bei der systemischen Therapie. Vaginale Applikationen sind die Therapie der ersten Wahl für die initiale Behandlung der menopausalen vaginalen Atrophie5. Bei der lokalen Hormontherapie ist zu beachten, dass die Estrogenwirkung weniger von der Dosis als von der Behandlungsdauer abhängig ist. Bei der Therapie einer atrophischen Kolpitis tritt häufig ein initiales Brennen auf. Während die Besserung der atrophischen Kolpitis bereits nach wenigen Tagen sichtbar wird, ist für die ausreichende Estrogenisierung im Beckenbodenbereich eine längere Behandlungsdauer notwendig42.
Für die Durchführung einer lokalen Estrogentherapie bieten sich verschiedene Anwendungsformen an, die sich zum Teil im Estrogenwirkstoff (v. a. Estriol, Estradiol) unterscheiden: Zäpfchen/Ovula, Creme, Vaginalring oder Tablette. In einer Cochrane-Metaanalyse6 wurden die unterschiedlichen Behandlungsmöglichkeiten hinsichtlich ihrer Wirksamkeit untersucht, indem 30 randomisiert kontrollierte Studien ausgewertet wurden. Es zeigten sich keine Unterschiede in der Effizienz zwischen Estrogen-Ring, -Tablette oder -Creme6, obwohl sich die Applikationsformen im Absorptionsgrad unterscheiden7.
Bei Anwendung einer lokalen Therapie nimmt die Estriolsubstitution eine zentrale Stellung ein8. Estriol ist ein natürlich vorkommendes Estrogen mit qualitativ ähnlichen Wirkungen, wie sie für Estrogene allgemein beschrieben werden9. Die vaginale Anwendung Estriol-haltiger galenischer Zubereitungen hat sich seit vielen Jahren bewährt und wird auch heute empfohlen10,11,12,13,14.
Estriol hat einen positiven Einfluss auf das Vaginalepithel, da es die epitheliale Proliferation induziert und die Reifung der epithelialen Zellen fördert. Atrophische Epithelien werden zu gut durchbluteten eutrophen Epithelien. Der Stärkegehalt der Zellen nimmt zu. Estriol fördert die Gefäßversorgung (Vaskularisierung) und Durchblutung des Gewebes. Vaginale Abstriche zeigen nach täglicher Applikation deutliche Änderungen vom atrophen Erscheinungsbild hin zu einem für eugonadale Frauen in der Zyklusmitte typischen Bild, das die epitheliale Reifung reflektiert15. Eine große Zahl klinischer Studien erzielte übereinstimmende Ergebnisse, die die positive Wirkung der vaginalen Applikation von Estriol überzeugend belegen16,17,18,19,20,21,22,23,24. Genazzani18 und Kicovic25 berichteten bereits zu Beginn der 1980er-Jahre, dass klinische und kolposkopische Befunde nach vaginaler Behandlung mit 0,5 mg oder 1,0 mg Estriol täglich für 2 bis 3 Wochen und anschließender Folgebehandlung mit Estriol einmal pro Woche günstig beeinflusst wurden. Neben den seit vielen Jahren etablierten Tagesdosen von 0,5 mg Estriol hat sich die ultraniedrige Dosierung von 0,03 mg Estriol zur vaginalen Therapie bewährt. In einer placebokontrollierten Studie über 12 Wochen wurde belegt, dass 0,03 mg Estriol gegenüber Placebo den vaginalen Reifungsindex, den vaginalen pH-Wert und das jeweils ausgeprägteste Symptom der Atrophie signifikant bessert43. Ultraniedrige vaginale Estrioldosierungen von 0,03 mg sind zur Behandlung der vulvovaginalen Atrophie in der Regel ausreichend.
Bei erheblich atrophisch und entzündlich veränderter Scheidenhaut bewähren sich Cremes zu Beginn der Therapie, da sie weniger Irritationen verursachen als feste Formulierungen. Später kann auf jeden Fall auf die festen Formen gewechselt werden. Bei zusätzlich ausgeprägten vasomotorischen Beschwerden und dem Einsatz einer systemischen Hormonsubstitution kann diese bei ausgeprägten urogenitalen Beschwerden auch mit einer lokalen Estrogenanwendung kombiniert werden26,27.
Eine maximale Wirkung ist nach einer vaginalen Verabreichung von Estriol über 14 bis 21 Tage zu erwarten. Es kommt zu einer deutlichen Reduzierung von Juckreiz, Brennen, Trockenheit und Dyspareunie, außerdem normalisiert sich das kolposkopische Bild (Abb. 1).
Auch die systemische Gabe von Estrogenen stellt den normalen vaginalen pH-Wert wieder her, verdickt das Epithel und verbessert die vaginale Befeuchtung, sodass die HRT neben anderen menopausalen Beschwerden auch die Symptome der vaginalen Atrophie behandelt (in 75 % der Fälle ist eine systemische Behandlung bei vaginaler Atrophie hilfreich). Zusätzlich wird die Inzidenz von Infekten der unteren Harnwege gesenkt26.
Die Wirksamkeit der systemischen Therapie wurde bereits 1998 in einer Metaanalyse von 58 Studien zu systemischer und lokaler Applikation dargestellt, wobei nur bei wenigen die Behandlung länger als 6 Monate beobachtet wurde28.
Eine Langzeitbeobachtung wurde in der WHI-Studie von 1993–2002 durchgeführt. Hier klagten in der HRT-Gruppe (Estrogen-Gestagen-Kombinationstherapie) 10 % der Frauen über Scheidentrockenheit. Das mittlere Alter der Frauen lag bei 63 Jahre. Nach einem Jahr berichteten 74 % der Frauen über eine Verbesserung, allerdings auch 54 % der Placebo-Gruppe29. Man geht davon aus, dass 10–25 % der Frauen, die mit einer systemischen HRT behandelt werden, weiterhin unter den vaginalen Symptomen leiden. Entsprechend kann bei einigen Frauen die Kombination einer systemischen mit einer lokalen Estrogentherapie notwendig sein, da insbesondere eine niedrig dosierte systemische Therapie26nicht ausreichend sein kann, um die vaginalen Beschwerden zufriedenstellend zu lindern.
Bei Frauen in den Wechseljahren kann bei vaginalen und weiteren menopausalen Beschwerden auch eine Kombinationsbehandlung aus systemischer Hormontherapie und initialer vaginaler Lokaltherapie mit Estriol sinnvoll sein26. So kann bei handelsüblichen Präparaten der systemischen Hormonsubstitution die Dosierung so niedrig gewählt sein, dass lokale Atrophiezeichen oft nicht ausreichend beeinflusst werden. Deshalb empfiehlt sich oftmals eine zusätzliche vaginale Estrogenapplikation, um eine bessere Proliferation in der Scheide und den unteren Harnwegen zu erreichen30. Hierbei schlägt positiv zu Buche, dass es zu keiner Kumulation bei der lokalen Therapie kommt.
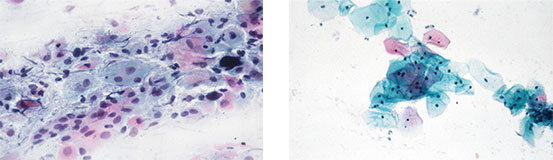
Ein wichtiges Indikationsgebiet für vaginales Estriol ist die hormonelle Aufhellungstherapie bei zytologischen Abstrichen zur Früherkennung von Dysplasien. Zytologische Abstrichbefunde können bei Atrophie in Einzelfällen starke entzündliche und degenerative Epithelveränderungen aufweisen, sodass die Abgrenzung von hochgradigen Dysplasien oder sogar Karzinomen nicht mehr möglich ist. Je nach Grad der Mangelsymptomatik treten vorwiegend Intermediärzellen mit vergrößerten Kernen und nur sehr wenige Superfizialzellen auf oder es kommt – bei Fortschreiten der vaginalen Atrophie – zu einem Überwiegen der Parabasalzellen.
Im Rahmen der Zytodiagnostik mittels Papanicolaou-Färbung können unklare Zellbilder nach lokaler Behandlung der Scheide mit Estriol über etwa 2 Wochen und anschließendem Durchführen eines erneuten Abstrichs meist richtig beurteilt werden. Über 80 % der zunächst unklaren Befunde lassen sich durch die Estriol-induzierte Reifung des Scheiden- und Portioepithels als unbedenklich einordnen (Gruppe-II-Befunde, gemäß Münchner Nomenklatur III31). Andererseits wird ein kleiner Teil der vorher verdächtigen Befunde pathologisch und als schwere Dysplasie, Mikrokarzinom oder Plattenepithelkarzinom diagnostiziert und kann dann zügig einer Behandlung zugeführt werden15,32,33. Die Abbildung 2 demonstriert den Erfolg einer Aufhellungstherapie mit Estriol.
Die lokale Anwendung von Estrogenen kann sowohl in der Prophylaxe als auch im Sinne einer begleitenden Therapie urogenitaler Infektionen ausgenutzt werden. In einer Metaanalyse wurde herausgestellt, dass bei Verwendung vaginaler Estrogene weniger wiederkehrende Harnwegsinfekte bei postmenopausalen Frauen auftraten, während das bei oraler Estrogentherapie nicht zu beobachten war34. Dieser Sachverhalt wird auch in der aktuellen S3-Leitlinie zu Harnwegsinfektionen35 gewürdigt: So stellt gemäß der Leitlinie die vaginale Applikation von 0,5 mg Estriol/Tag bei Frauen in der Postmenopause ein mögliches Konzept der Rezidivprophylaxe von Harnwegsinfektionen dar.
Gemäß der aktuellen interdisziplinären S2e-Leitlinie für die Diagnostik und Therapie der Belastungsinkontinenz der Frau36 verbessert die intravaginale Estrogenapplikation bei postmenopausalen Frauen vaginale Beschwerden und Symptome des unteren Harntraktes unabhängig davon, ob eine Atrophie der Vaginalhaut vorliegt. Intravaginal verabreichte Estrogene können eine Harninkontinenz bei postmenopausalen Frauen verbessern oder heilen. Eine lokale Estrogentherapie soll allen postmenopausalen Patientinnen mit Harninkontinenz empfohlen werden. Unklar bleibt die Therapiedauer (LOE 1a, Empfehlungsgrad A)36.
Eine Estrogenbehandlung vorzugsweise mit Estriol oder niedrig dosiertem Estradiol zur Verbesserung der pelvinen und urethralen Durchblutung und Tonisierung des Beckenbodens kann bei verschiedenen Schweregraden der Belastungsinkontinenz sinnvoll sein37. Der topischen Applikation soll der Vorzug vor einer systemischen Behandlung mit Estrogenen gegeben werden. Physiotherapeutische Maßnahmen wie Beckenbodentraining, Miktionstraining und Elektrostimulation sowie Biofeedback-Methoden sind in der Therapie der Stressinkontinenz von wesentlicher Bedeutung38.
Anwendung vaginaler Estrogene bei Brustkrebspatientinnen
Das Mammakarzinom ist weiterhin die häufigste Krebserkrankung bei Frauen und tritt insbesondere in der Postmenopause auf. Bei den meisten Patientinnen handelt es sich um ein hormonrezeptorpositives Karzinom, welches mithilfe einer endokrinen Therapie (Tamoxifen oder Aromatasehemmer) behandelt wird44. Um Rezidive und Mortalität zu verringern, wird aktuell empfohlen, die adjuvante endokrine Therapie standardmäßig 5 Jahre45,46und als erweiterte Therapie bis zu 10 Jahre anzuwenden47. Daher müssen auch auftretende Nebenwirkungen entsprechend behandelt werden47.
Durch die anti-estrogene Wirkung von Tamoxifen und Aromatasehemmern sind die meisten Nebenwirkungen östrogenmangelbedingt und ähneln den typischen Symptomen während der Wechseljahre. Allerdings sind die Beschwerden häufig viel stärker ausgeprägt als die durchschnittlichen Wechseljahressymptome und können die Lebensqualität deutlich beeinträchtigen48. Neben vasomotorischen Symptomen kommt es auch bei bis zu 20 % der Therapieanwenderinnen zu einer vaginalen Atrophie49 mit enormem Leidensdruck bei den Mammakarzinom-Patientinnen44.
Häufig können die durch eine endokrine Therapie hervorgerufenen urogenitalen Beschwerden vermieden bzw. reduziert werden oder sind gut kontrollierbar – vorausgesetzt sie werden früh erkannt und adäquat behandelt50,51. Ziel der Behandlung ist es, die Symptome zu lindern und die mit dem Estrogenmangel assoziierten atrophischen Veränderungen aufzuhebenv52,53. Allerdings ist bei Patientinnen mit vorangegangenem hormonrezeptorpositivem Brustkrebs aufgrund des möglicherweise erhöhten Brustkrebsrisikos eine lokale oder systemische Hormontherapie kontraindiziert54. Infolgedessen gelten hormonfreie Behandlungsformen als erste Wahl. Diese haben jedoch den Nachteil, dass sie die Beschwerden nur teilweise oder nur kurzzeitig lindern und weniger wirksam als vaginal verabreichtes Estrogen sind48.
Bei andauernden und die Lebensqualität einschränkenden Symptomen kann daher gemäß aktueller Empfehlungen von Fachgesellschaften in Ausnahmefällen und bei Versagen von Alternativen auch eine Hormontherapie in Erwägung gezogen werden2,3,48,55, auch wenn die Studienlage dazu limitiert ist. Niedrig-dosierte vaginale Estrogentherapien sind wirksam und weisen aufgrund der minimalen systemischen Absorption generell ein gutes Sicherheitsprofil auf. Angesichts des potenziellen Risikos für einen geringen Anstieg der im Blut zirkulierenden Estrogene sollte eine niedrig-dosierte vaginale Estrogentherapie bei Brustkrebspatientinnen nur in Rücksprache mit dem behandelnden Onkologen begonnen werden3.
In einer Beobachtungsstudie56 wurde gezeigt, dass Patientinnen mit vorangegangenem Mammakarzinom, die eine Tamoxifen- bzw. Aromatasehemmer-Therapie erhielten, beim Einsatz von niedrig-dosiertem Estrogen über 3,5 Jahre kein erhöhtes Risiko für ein Mammakarzinom-Rezidiv aufwiesen.
In Studien mit Messungen von Estrogenspiegeln unter lokaler Estrogentherapie wurden überwiegend nur kurzfristige Anstiege der Spiegel nach den ersten Applikationen gezeigt44. Beispielsweise wurden in einer Pharmakokinetik-Studie57 mit Brustkrebspatientinnen unter einer Aromatasehemmer-Therapie nach Anwendung von ultra-niedrig dosiertem vaginalem Estriol (0,03 mg) mit Milchsäurebakterien zur Behandlung einer schweren vaginalen Atrophie die Estrogenspiegel im Serum gemessen. Nach der vaginalen Applikation konnte zu keinem Zeitpunkt des Therapieverlaufs ein Anstieg der Konzentrationen von Estron (E1) und Estradiol (E3) verzeichnet werden. Die Estriol(E2)-Konzentration war nach der ersten Anwendung auf max. 168 pg/ml erhöht, dieser Anstieg betrug nach 4 Wochen jedoch nur noch max. 44 pg/ml.
Weitere hormonelle Therapieoptionen
Wenn eine lokale vaginale Estrogentherapie zur Behandlung der mittelschweren bis schweren symptomatischen vulvovaginalen Atrophie (VVA) bei postmenopausalen Frauen nicht in Frage kommt, kann auch der selektive Estrogenrezeptormodulator (SERM) Ospemifen eingesetzt werden39,58. Klinische Daten haben zudem gezeigt, dass das synthetische Steroid Tibolon40 und Dehydroepiandrosteron (DHEA)41 positive Wirkungen bei der Behandlung der vaginalen Atrophie aufweisen. Insbesondere bei DHEA sind aber noch weitere Studien zur endgültigen Bewertung nötig1.
-
Gandhi, J., et al. (2016, Dec). Genitourinary syndrome of menopause: an overview of clinical manifestations, pathophysiology, etiology, evaluation, and management. Am J Obstet Gynecol, 215(6), pp. 704-11.
-
Baber, R., Panay, N., Fenton, A., & for the IMS Writing Group. (2016). IMS Recommendations on women's midlife health and menopause hormone therapy. Climacteric, 19(2), pp. 109-50.
-
NAMS (The North American Menopause Society). (2017, Jun). The 2017 hormone therapy position statement of The North American Menopause Society. Menopause: The Journal of The North American Menopause Society, 24(7), pp. 728-53.
-
Sturdee, D., Panay, N., & Group, I. M. (2010, Dec). Recommendations for the management of postmenopausal vaginal atrophy. Climacteric, 13(6), pp. 509-22.
-
Archer, D. (2010, Jan-Feb). Efficacy and tolerability of local estrogen therapy for urogenital atrophy. Menopause, 17(1), pp. 194-203.
-
Lethaby, A., Ayeleke, R., & Roberts, H. (2016, Aug). Local oestrogen for vaginal atrophy in postmenopausal women. Cochrane Database Syst Rev, 8, p. CD001500.
-
Lester, J., Pahouja, G., Andersen, B., & Lustberg, M. (2015, Mar). Atrophic vaginitis in breast cancer survivors: a difficult survivorship issue. J Pers Med, 5(2), pp. 50-66.
-
Robinson, D., & Cardozo, L. (2003, Mar). The menopause and HRT. Urogenital effects of hormone therapy. Best Pract Res Clin Endocrinol Metab, 17(1), pp. 91-104.
-
Sweetman, S. (2005). Sex hormones. In S. Sweetman, Martindale: The Complete Drug Reference (34th ed., pp. 1550-3). Pharmaceutical Press.
-
Strecker, J., & Lauritzen, C. (1989). Praxis der Hormonbehandlung im Klimakterium. Stuttgart: Enke Verlag.
-
Wolf, A. (1991). Hormonelle Altersveränderungen aus der Sicht des Gynäkologen. Fortschr Med, 109(18), S. 28-34.
-
Facchinetti, F., et al. (1992). Psychosomatic disorders related to gynecology. Psychother Psychosom, 58(3-4), pp. 137-54.
-
Hauser, G. (1999). Häufigkeit der einzelnen klimakterischen Symptome und ihr unterschiedliches Ansprechen auf die Hormonersatztherapie. J Menopause, 6(2), S. 42-7.
-
Dessole, S., et al. (2004, Jan-Feb). Efficacy of low-dose intravaginal estriol on urogenital aging in postmenopausal women. Menopause, 11(1), pp. 49-56.
-
Buquoy (Graf von), F., & Schröck, R. (1982). Lokaltherapie mit Estriol in der Gynäkologie (Ergebnisse einer klinisch-ambulanten Studie). Gyne 2 (Sonderdruck).
-
Luisi, M., Franchi, F., & Kicovic, P. (1980, Dec). A group-comparative study of effects of Ovestin cream versus Premarin cream in post-menopausal women with vaginal atrophy. Maturitas, 2(4), pp. 311-9.
-
Haspels, A., Luisi, M., & Kicovic, P. (1981, Dec). Endocrinological and clinical investigations in post-menopausal women following administration of vaginal cream containing oestriol. Maturitas, 3(3-4), pp. 321-7.
-
Genazzani, A., Inaudi, F., La Rosa, R., & al., e. (1982). Oestriol and the menopause – Clinical and endocrinological results of vaginal administration. Serono Symposium No. 39. In P. Fioretti, L. Martini, G. Melis, & S. Yen (Eds.). London, New York: Academic Press.
-
Van der Velden, W., Trevoux, R., & Popovic, D. (1982). Cream containing oestriol for the treatment of menopausal vaginal atrophy. In P. Fioretti, L. Martini, G. Melis, & S. Yen (Eds.), The menopause – Clinical, endocrinological and pathophysiological aspects. Serono Symposium No. 39 (pp. 535-8). London, New York: Academic Press.
-
Trevoux, R., van der Velden, W., & Popović, D. (1982, Apr-Jun). Ovestin vaginal cream and suppositories for the treatment of menopausal vaginal atrophy. Reproduccion, 6(2), pp. 101-6.
-
Richards, C. (1990). Double-blind study to evaluate the efficacy of a sustained-release vaginal formulation of oestriol in alleviating urogential and systemic postmenopausal complaints (Abstract 046). 6th International Congress on the Menopause Bangkok, 29 October - 2 November 1990. New Jersey: The Parthenon Publishing Group Lancs.
-
Henriksson, L., et al. (1994, Sep). A comparative multicenter study of the effects of continuous low-dose estradiol released from a new vaginal ring versus estriol vaginal pessaries in postmenopausal women with symptoms and signs of urogenital atrophy. Am J Obstet Gynecol, 171(3), pp. 624-32.
-
Bottiglione, F., Volpe, A., Esposito, G., & Aloysio, D. (1995, Nov). Transvaginal estriol administration in postmenopausal women: a double blind comparative study of two different doses. Maturitas, 22(3), pp. 227-32.
-
Rueda, C., et al. (2017, Aug). The efficacy and safety of estriol to treat vulvovaginal atrophy in postmenopausal women: a systematic literature review. Climacteric, 20(4), pp. 321-30.
-
Kicovic, P., et al. (1980, Dec). The treatment of postmenopausal vaginal atrophy with Ovestin vaginal cream or suppositories: clinical, endocrinological and safety aspects. Maturitas, 2(4), pp. 275-82.
-
Sturdee, D., Panay, N., & Society, i. N. (2010). Empfehlungen zum Vorgehen bei postmenopausaler vaginaler Atrophie, 1. Oktober 2010. J Gynäkol Endokrinol, 13(4), S. 8-21.
-
Neves-E-Castro, et al. (2015, May). EMAS position statement: The ten point guide to the integral management of menopausal health. Maturitas, 81(1), pp. 88-92.
-
Cardozo, L., et al. (1998, Oct). Meta-analysis of estrogen therapy in the management of urogenital atrophy in postmenopausal women: second report of the Hormones and Urogenital Therapy Committee. Obstet Gynecol, 92(4 Pt 2), pp. 722-7.
-
Barnabei, V., et al. (2005, May). Menopausal symptoms and treatment-related effects of estrogen and progestin in the Women's Health Initiative. Obstet Gynecol, 105(5 Pt 1), pp. 1063-73.
-
Birtalan, I. (1999). Estring – eine neue lokale Östrogentherapie bei vaginaler und urogenitaler Atrophie. J für die Menopause, 6, pp. 17-21.
-
Griesser, H., et al. (2013). Gynäkologische Zytodiagnostik der Zervix: Münchner Nomenklatur III. Frauenarzt, 11, S. 1042-8.
-
Clocuh, Y. (1980). Oestrogengabe als hormonelle Aufhellung zur Abklärung atrophischer Zellabstriche. Geburtsh Frauenheilk, 40, S. 1121-9.
-
Pschyrembel, W., Strauss, G., & Petri, E. (Hrsg.). (1991). Praktische Gynäkologie (5. Ausg.). Berlin: Walter de Gruyter.
-
Beerepoot, M., et al. (2013, Dec). Nonantibiotic prophylaxis for recurrent urinary tract infections: a systematic review and meta-analysis of randomized controlled trials. J Urol, 190(6), pp. 1981-9.
-
Deutsche Gesellschaft für Urologie. (Apr 2017). Interdisziplinäre Leitlinie der Qualität S3 zur Epidemiologie, Diagnostik, Therapie, Prävention und zum Management unkomplizierter, bakterieller, ambulant erworbener Harnwegsinfektionen bei erwachsenen Patienten. AWMF-Register-Nr. 043/044.
-
Interdisziplinäre S2e-Leitlinie. (Jul 2013). Diagnostik und Therapie der Belastungsinkontinenz der Frau. Von AWMF-Register-Nr. 015/005: www.awmf.org/uploads/tx_szleitlinien/015_005l_S2e_Belastungsinkontinenz_2013-07.pdf abgerufen
-
Jackson, S., et al. (1996). The effect of estradiol on vaginal collagen in postmenopausal women with stress urinary incontinence. Neurourol Urodyn, 15, pp. 327-8.
-
Fantl, J., et al. (1991, Feb). Efficacy of bladder training in older women with urinary incontinence. JAMA, 265(5), pp. 609-13.
-
Shin, J., Kim, S., Lee, J., & Suh, C. (2017, Aug). Ospemifene: A Novel Option for the Treatment of Vulvovaginal Atrophy. J Menopausal Med, 23(2), pp. 79-84.
-
Sismondi, P., et al. (2011, Dec). Effects of tibolone on climacteric symptoms and quality of life in breast cancer patients--data from LIBERATE trial. Maturitas, 70(4), pp. 365-72.
-
Labrie, F., et al. (2017, Jun). Science of intracrinology in postmenopausal women. Menopause, 24(6), pp. 702-12.
-
Kuhl, H. (2006). Klimakterium, Postmenopause und Senium. In M. Kaufmann, S. Costa, & A. Scharl (Hrsg.), Die Gynäkologie (2. Ausg.). Heidelberg: Springer.
-
Griesser, H., et al. (2012, Apr). Low dose estriol pessaries for the treatment of vaginal atrophy: a double-blind placebo-controlled trial investigating the efficacy of pessaries containing 0.2mg and 0.03mg estriol. Maturitas, 71(4), pp. 360-8.
-
Moegele, M., Buchholz, S., Mueck, A., & Ortmann, O. (2016). Vaginale Östrogentherapie nach Mammakarzinom. Frauenarzt, 57(1), S. 36-46.
-
Goldhirsch, A., et al. (2013, Sep). Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol, 24(9), pp. 2206-23.
-
Partridge, A., et al. (2014, Jun). First international consensus guidelines for breast cancer in young women (BCY1). Breast, 23(3), pp. 209-20.
-
Burstein, H., et al. (2014, Jul). Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer: american society of clinical oncology clinical practice guideline focused update. J Clin Oncol, 32(21), pp. 2255-69.
-
Sousa, M., et al. (2017, Apr). A clinical guide to the management of genitourinary symptoms in breast cancer survivors on endocrine therapy. Ther Adv Med Oncol, 9(4), pp. 269-85.
-
Fallowfield, L., et al. (2004, Nov). Quality of life of postmenopausal women in the Arimidex, Tamoxifen, Alone or in Combination (ATAC) Adjuvant Breast Cancer Trial. J Clin Oncol, 22(21), pp. 4261-71.
-
Lu, R., & Serrero, G. (2001, Jan). Mediation of estrogen mitogenic effect in human breast cancer MCF-7 cells by PC-cell-derived growth factor (PCDGF/granulin precursor). Proc Natl Acad Sci U S A, 98(1), pp. 142-7.
-
Vincent, A. (2015, Oct). Management of menopause in women with breast cancer. Climacteric, 18(5), pp. 690-701.
-
Kingsberg, S., Kellogg, S., & Krychman, M. (2009, Aug). Treating dyspareunia caused by vaginal atrophy: a review of treatment options using vaginal estrogen therapy. Int J Womens Health, 1, pp. 105–11.
-
Palacios, S., Mejía, A., & Neyro, J. (2015). Treatment of the genitourinary syndrome of menopause. Climacteric, 18(Suppl 1), pp. 23-9.
-
Co-ordination Group for Mutual Recognition and Decentralised procedures - Human (CMDh). (2017, Feb). CORE SmPC for Hormone Replacement Therapy Products.
-
Mueck AO (2015). Anwendungsempfehlungen zur Hormonsubstitution in Klimakterium und Postmenopause. Frauenarzt 56(8):657-660.
-
Le Ray, I., et al. (2012, Sep). Local estrogen therapy and risk of breast cancer recurrence among hormone-treated patients: a nested case-control study. Breast Cancer Res Treat, 135(2), pp. 603-9.
-
Donders, G., et al. (2014, Jun). Ultra-low-dose estriol and Lactobacillus acidophilus vaginal tablets (Gynoflor®) for vaginal atrophy in postmenopausal breast cancer patients on aromatase inhibitors: pharmacokinetic, safety, and efficacy phase I clinical study. Breast Cancer Res Treat, 145(2), pp. 371-9.
-
Shionogi GmbH, (Feb 2017). Senshio® 60 mg Filmtabletten. Fachinformation.


