Hormonersatztherapie
Bei der Hormonersatztherapie (engl.: Hormone Replacement Therapy = HRT) handelt es sich um eine Substitutionstherapie mit Estrogenen (überwiegend Estradiol, seltener konjugierte Stutenestrogene) in Kombination mit oder auch ohne Gestagene (Progesteron, synthetische Gestagene). Zur Hormonersatztherapie werden in der Regel natürliche Estrogene wie Estradiol eingesetzt. Das synthetische Estrogen Ethinylestradiol ist für die Langzeittherapie menopausaler Beschwerden aufgrund der starken Wirkung auf den Leberstoffwechsel und dem damit erhöhten VTE-Risiko nicht geeignet.
Was ist die Hormonersatztherapie und wann wird sie angewendet?
Die HRT ist weiterhin die wirksamste Behandlung von Estrogenmangelbeschwerden wie vasomotorischer Symptome1,2,3,4 und urogenitaler Atrophie1,3,4. Leidet die Patientin isoliert an atrophischen Veränderungen des Urogenitaltraktes, so ist eine ausschließlich lokale Hormonbehandlung angezeigt4,5,6.
Bei nicht hysterektomierten Frauen muss bei einer systemischen Therapie mit Estrogenen immer zusätzlich ein Gestagen angewendet werden, da bei alleiniger Gabe von Estrogenen ein erhöhtes Risiko für eine Endometriumhyperplasie und die Entwicklung eines Endometriumkarzinoms besteht6,7,8. Bei einer (niedrig-dosierten) lokalen Hormontherapie wird die Kombination mit einem Gestagen nicht empfohlen4,9.
Bioidentische Hormontherapie
Eine bioidentische, natürliche oder naturidentische Hormonersatztherapie bezeichnet die Verwendung von Hormonpräparaten, die mit den vom menschlichen Körper gebildeten Hormonen identisch und daher besonders gut verträglich sind. Eine systemisch wirksame kombinierte Hormontherapie kann nur bei Verwendung von Estradiol (insbesondere bei transdermaler Applikation) in Kombination mit oral oder vaginal verabreichtem Progesteron als „bioidentisch“ bezeichnet werden10.
Die bioidentischen Hormone Estradiol und Progesteron
Estradiol kann insbesondere bei der transdermalen Auftragung als bioidentisch bezeichnet werden, da dem Körper hierbei die Mengen an Estradiol zugeführt werden, die in der reproduktiven Zeit vom Ovar sezerniert werden. Außerdem wird bei transdermaler Applikation die Leberpassage umgangen und Estradiol gelangt wie bei der ovariellen Sekretion direkt ins venöse System10. In der letzten Zeit wurden viele Vorteile dieses Zugangsweges beschrieben11,12, im Hinblick auf Nüchternglukose, Insulinresistenz bei Frauen mit metabolischem Syndrom und sogar mit Diabetes sowie auf den Blutdruck. In Beobachtungsstudien wurde außerdem von einer geringeren Rate kardiovaskulärer Ereignisse (v. a. Schlaganfälle und venöse Thromboembolien) im Vergleich zur oralen Anwendung berichtet13,14.
Im Gegensatz zu Estradiol bestehen konjugierte Stutenestrogene (CEE), gewonnen aus dem Urin trächtiger Stuten, aus einer Mischung von vielen verschiedenen Steroiden, die zum Teil humanen Hormonen ähneln, aber physiologischerweise nicht beim Menschen vorkommen und unbekannte Eigenschaften besitzen14. In CEE sind über 50 % Estron oder Estron-Konjugate enthalten, die in individuell variablem Umfang zu Estradiol metabolisiert werden. Die Dosis-Wirkung-Beziehung dieser Mischungen und ihr Nettoeffekt kann aufgrund der vielen verschiedenen biologisch aktiven Substanzen nicht vorausgesagt werden10.
Natürliches Progesteron war in früheren Zeiten eine sehr teure Substanz, weil es aus trächtigen Tieren isoliert wurde. Dies änderte sich, als die Synthese großer Mengen reinen Progesterons aus dem Pflanzenstoff Diosgenin gelang15. Allerdings waren sehr hohe orale Dosen der damaligen Progesteron-Zubereitungen notwendig, um biologische Effekte zu erzielen. Deshalb kamen zunächst vermehrt synthetische Gestagene zum Einsatz, bei denen durch Molekülveränderungen eine höhere Wirksamkeit bei oraler Verabreichung erreicht wurde. Allerdings fehlen synthetischen Gestagenen wesentliche physiologische Eigenschaften des Progesterons. Fortschritte in der Galenik, vor allem die Mikronisierung der Substanzpartikel, führten zu Verbesserungen der Resorption von Progesteron und ermöglichten ab 1980 eine orale Therapie mit natürlichem Progesteron16. Humanidentische Progesteron-Moleküle werden weiterhin unter Verwendung natürlicher Ausgangstoffe der Yamswurzel (Diosgenin) oder der Sojabohne (Stigmasterin) hergestellt.
Applikationswege
Prinzipiell können Estrogene oral (Tabletten), transdermal (Gele, Pflaster, Spray), vaginal (Creme, Suppositorien, Vaginalringe), parenteral (Depotinjektionen, Implantate) und nasal (als Spray) verabreicht werden. Bei der systemischen Estrogentherapie ist die orale bzw. die transdermale Anwendung führend.
Die ideale Applikationsform soll die menopausalen Symptome lindern, eine niedrige Exposition an Estrogen erlauben, Wechselwirkungen mit anderen Medikamenten und körpereigenen Stoffwechselwegen minimieren sowie eine große Akzeptanz bei den Frauen besitzen und damit die Compliance verbessern. Die transdermalen Anwendungen bieten den Vorteil, dass sie den hepatischen First-Pass-Effekt umgehen. Obgleich es keine randomisierten kontrollierten Studien gibt, legen verschiedene Beobachtungsstudien (5 Fall-Kontrollstudien17,18,19,20,21,22 und 3 Kohortenstudien23,24,25) nahe, dass dadurch das Risiko für venöse Thrombosen im Gegensatz zur oralen Anwendung nicht erhöht ist. Bei allen transdermalen Darreichungsformen reichen im Vergleich zu oralen Anwendungen geringere bioverfügbare Dosen aus, da die Wirkstoffe direkt über die Blutbahn ans Ziel transportiert werden können und nicht zum großen Teil schon im Magen-Darm-Trakt abgebaut werden.
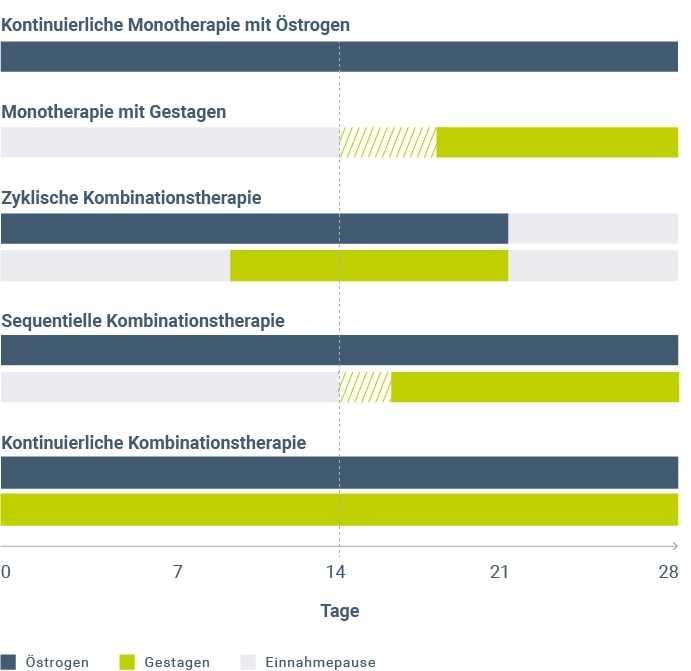
Applikationsformen
(Siehe Abb. 1)
Kontinuierliche Monotherapie mit Estrogenen
Bei hysterektomierten Frauen kann der Estrogenmangel durch die alleinige Gabe von einem Estrogen ausgeglichen werden. Gestagene zum Endometriumschutz sind entsprechend nicht notwendig. Eine Ausnahme kann eine Hormontherapie bei hysterektomierten Frauen mit Endometriose darstellen. Aufgrund einer möglichen malignen Transformation residualer Endometrioseherde und eines erhöhten Rezidivrisikos durch eine ungehinderte Estrogenstimulation wird vorsichtshalber eine kontinuierliche Hormontherapie mit Gestagenzusatz oder die Anwendung von Tibolon empfohlen26. Die Datenlage zur Anwendung verschiedener Hormontherapie-Regimes ist allerdings stark begrenzt.
Monotherapie mit einem Gestagen
Kennzeichnend für die Perimenopause ist das Auftreten von Zyklusunregelmäßigkeiten, die unter anderem durch ein gehäuftes Auftreten anovulatorischer Zyklen und einem dadurch erzeugten Progesteronmangel entstehen. Zur Zyklusstabilisierung wird wie auch bei der prämenopausalen Lutealinsuffizienz in der zweiten Zyklushälfte mikronisiertes Progesteron bzw. ein synthetisches Gestagen über mindestens 10–14 Tage zugeführt.
Zyklische Kombinationstherapie
Bei der zyklischen Anwendung wird das Estrogen über 21 Tage ohne Unterbrechung angewendet und danach eine einwöchige Pause eingelegt. In den letzten 12–14 Tagen der Estrogengabe wird zusätzlich ein Gestagen verabreicht. Die zyklische Anwendung ist der Versuch, den physiologischen, d. h. prämenopausalen Zyklus weiterzuführen bzw. zu stabilisieren.
In der einwöchigen Pause können v. a. zu Beginn der Behandlung Abbruchblutungen auftreten. Die zyklische Verabreichung der Hormone eignet sich vor allem für jüngere Frauen (Peri- und frühe Postmenopause) und als Beginn einer HRT. Da während der Estrogen-freien Woche die menopausalen Beschwerden wiederkehren können und die korrekte Einhaltung des Therapieschemas für Anwenderinnen schwierig ist, wird dieses Schema eher selten eingesetzt.
Der Begriff "zyklische Kombinationstherapie" wird häufig synonym zur "sequentiellen HRT" verwendet. Eine einheitliche Nomenklatur gibt es hierzu nicht.
Sequentielle Kombinationstherapie
Bei diesem Therapieschema wird das Estrogen täglich ohne Pause verabreicht und das Gestagen für die letzten 12–14 Tage eines Behandlungszyklus zugegeben. Neben der Behandlung menopausaler Beschwerden ist auch die Regulierung des Zyklus ein häufiges Ziel dieser Therapieform. Bei diesem Schema kommt es v. a. bei jüngeren Frauen zu einer Abbruchblutung. Der fehlende Estrogenentzug im Vergleich zur "zyklischen Kombinationstherapie" wird häufig als vorteilhaft empfunden.
Kontinuierliche Kombinationstherapie
Mit dem Ziel der Blutungsfreiheit werden bei der kontinuierlichen Kombinationstherapie Estrogen und Gestagen täglich durchgehend verabreicht. Dieses Schema eignet sich besonders für Frauen in der Postmenopause im Anschluss an eine zyklische/sequentielle HRT. Es zeichnet sich durch Einfachheit aus und erlaubt, insbesondere nach individueller Feinabstimmung der Dosierung, eine problemlose, langfristige Anwendung, die dem Wunsch vieler Frauen nach Blutungsfreiheit in der Postmenopause gerecht wird.
Indikationen
Eine medizinische Notwendigkeit zur Behandlung mit Estrogenen ist angezeigt* bei:
- die Lebensqualität beeinträchtigenden klimakterischen Symptomen
- Klimakterium praecox oder prämaturer Ovarialinsuffizienz; natürlich oder induziert (chirurgisch, Strahlen- oder Chemotherapie)
- atrophischen Veränderungen im Genitalbereich
- hohem Frakturrisiko zur Prävention einer Osteoporose bei postmenopausalen Frauen, die eine Unverträglichkeit oder Kontraindikation gegenüber anderen zur Osteoporoseprävention zugelassenen Arzneimitteln aufweisen
* Bitte beachten Sie die jeweilige Indikationsstellung der einzelnen Präparate zur Hormontherapie.
Kontraindikationen
Eine HRT sollte in folgenden Situationen nicht angewendet werden27*:
- bestehender oder früherer Brustkrebs bzw. ein entsprechender Verdacht
- estrogenabhängiger maligner Tumor (v. a. Endometriumkarzinom) bzw. ein entsprechender Verdacht
- nicht abgeklärte Blutungen im Genitalbereich
- unbehandelte Endometriumhyperplasie
- frühere idiopathische oder bestehende venöse thromboembolische Erkrankungen (v. a. tiefe Venenthrombose, Lungenembolie)
- bekannter thrombophiler Defekt und Thrombosen bei Verwandten in der Anamnese oder schwerwiegende thrombophile Erkrankungen (z. B. Protein-C-, Protein-S- oder Antithrombin-Mangel)
- bestehende oder erst kurze Zeit zurückliegende arterielle thromboembolische Erkrankung (v. a. Angina pectoris, Myokardinfarkt)
- akute Lebererkrankung oder zurückliegende Lebererkrankungen, solange sich die relevanten Leberenzym-Werte nicht normalisiert haben
- Porphyrie
- bekannte Überempfindlichkeit gegenüber den Wirkstoffen oder einem Hilfsstoff
Patienten mit der seltenen hereditären Galaktose-Intoleranz, Lapp-Laktase-Mangel oder Glukose-Galaktose-Malabsorption sollten Laktose-haltige Formulierungen nicht einnehmen.
* Bitte beachten Sie außerdem die Hinweise in den Fachinformationen der jeweiligen Präparate.
Situationen, die eine Überwachung erfordern
Die Patientinnen sollten bei einer HRT besonders engmaschig überwacht werden, wenn eine der folgenden Situationen bzw. Erkrankungen vorliegt oder früher vorlag bzw. sich während einer Schwangerschaft oder einer zurückliegenden Hormonbehandlung verschlechtert hat27*:
- Leiomyom (Uterusmyom) oder Endometriose
- Risikofaktoren für Thromboembolien
- Risikofaktoren für estrogenabhängige Tumoren, z. B. Auftreten vom Mammakarzinom bei Verwandten 1. Grades
- Hypertonie
- Lebererkrankungen (z. B. Leberadenom)
- Diabetes mellitus mit oder ohne Beteiligung der Gefäße
- Cholelithiasis
- Migräne oder (schwere) Kopfschmerzen
- systemischer Lupus erythematodes (SLE)
- Endometriumhyperplasie in der Vorgeschichte
- Epilepsie
- Asthma
- Otosklerose
Es sollte in Betracht gezogen werden, dass möglicherweise diese Situationen oder Krankheiten während der Behandlung mit einem systemischen HRT-Präparat wieder auftreten oder sich verschlimmern können.
* Bitte beachten Sie außerdem die Hinweise in den Fachinformationen der jeweiligen Präparate.
-
de Villiers, T., et al. (2013, Apr). Global consensus statement on menopausal hormone therapy. Climacteric, 16(2), pp. 203-4.
-
Grant MD, et al. (2015). Menopausal Symptoms: Comparative Effectiveness of Therapies. Rockville (MD).
-
Stuenkel CA, et al. (2015). Treatment of Symptoms of the Menopause: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab;100(11):3975-4011.
-
Baber, R., Panay, N., Fenton, A., & for the IMS Writing Group. (2016). IMS Recommendations on women's midlife health and menopause hormone therapy. Climacteric, 19(2), pp. 109-50.
-
Mueck AO (2015). Anwendungsempfehlungen zur Hormonsubstitution in Klimakterium und Postmenopause. Frauenarzt 56(8):657-660.
-
NAMS (The North American Menopause Society). (2017, Jun). The 2017 hormone therapy position statement of The North American Menopause Society. Menopause: The Journal of The North American Menopause Society, 24(7), pp. 728-53.
-
Furness, S., Roberts, H., Marjoribanks, J., & Lethaby, A. (2012, Aug). Hormone therapy in postmenopausal women and risk of endometrial hyperplasia. Cochrane Database Syst Rev(8), p. CD000402.
-
Sjögren, L., Mørch, L., & Løkkegaard, E. (2016, Sep). Hormone replacement therapy and the risk of endometrial cancer: A systematic review. Maturitas, 91, pp. 25-35.
-
National Institute for Health and Care Excellence (NICE). (2015, Nov). NICE Guideline. Menopause: Diagnose and Management.
-
Mueck, A. (Jan 2017). Transdermales Östradiol und Progesteron. Die einzig bioidentische HRT, diskutiert auf dem NAMS-Kongress 2016. Gynäkolog Endokrin, 15(1), S. 65-72.
-
L'hermite, M., Simoncini, T., Fuller, S., & Genazzani, A. (2008, Jul-Aug). Could transdermal estradiol + progesterone be a safer postmenopausal HRT? A review. Maturitas, 60(3-4), pp. 185-201.
-
L'Hermite, M. (2013, Aug). HRT optimization, using transdermal estradiol plus micronized progesterone, a safer HRT. Climacteric, 16(Suppl 1), pp. 44-53.
-
Simon, et al., (2016, Jun). Venous thromboembolism and cardiovascular disease complications in menopausal women using transdermal versus oral estrogen therapy. Menopause: The Journal of The North American Menopause Society, 23(6), pp. 600-10.
-
L'Hermite, M. (2017, Aug). Bioidentical menopausal hormone therapy: registered hormones (non-oral estradiol ± progesterone) are optimal. Climacteric, 20(4), pp. 331-8.
-
Loose, D., & Stancel, G. (2006). Estrogens and progestins. In L. Brunton (Ed.), Godman & Gilman’s the pharmacological basis of therapeutics (11th ed., pp. 1541-71). New York: McGras-Hill.
-
Morville, R., Dray, F., Reynier, J., & Barrat, J. (1982). Biodisponibilité de la progestérone naturelle administrée par voie orale. Mesure des concentrations du stéroïde dans le plasma, l’endomêtre et le tissu mammaire. J Gynecol Obstet Biol Reprod, 11, pp. 355-63.
-
Daly, E., et al. (1996, Oct). Risk of venous thromboembolism in users of hormone replacement therapy. Lancet, 348(9033), pp. 977-80.
-
Pérez Gutthann, S., García Rodríguez, L., Castellsague, J., & Duque Oliart, A. (1997, May). Hormone replacement therapy and risk of venous thromboembolism: population based case-control study. BMJ, 314(7083), pp. 796-800.
-
Scarabin, P., Oger, E., Plu-Bureau, G., & Group, E. a. (2003, Aug). Differential association of oral and transdermal oestrogen-replacement therapy with venous thromboembolism risk. Lancet, 362(9382), pp. 428-32.
-
Douketis, J., et al. (2005). Does the type of hormone replacement therapy influence the risk of deep vein thrombosis? A prospective case-control study. J Thromb Haemost, 3(5), pp. 943-8.
-
Canonico, M., et al. (2007, Feb). Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study. Circulation, 115(7), pp. 840-5.
-
Roach, R., et al. (2013). The risk of venous thrombosis in women over 50 years old using oral contraception or postmenopausal hormone therapy. J Thromb Haemost, 11(1), pp. 124-31.
-
Canonico, M., et al. (2010, Feb). Postmenopausal hormone therapy and risk of idiopathic venous thromboembolism: results from the E3N cohort study. Arterioscler Thromb Vasc Biol, 30(2), pp. 340-5.
-
Renoux, C., Dell'aniello, S., Garbe, E., Suissa, S. (2010, Jun). Transdermal and oral hormone replacement therapy and the risk of stroke: a nested case-control study. BMJ, 340, p. c2519.
-
Sweetland, S., et al. (2012). Venous thromboembolism risk in relation to use of different types of postmenopausal hormone therapy in a large prospective study. J Thromb Haemost, 10(11), pp. 2277-86.
-
Moen, M., et al. (2010, Sep). EMAS position statement: Managing the menopause in women with a past history of endometriosis. Maturitas, 67(1), pp. 94-7.
-
Co-ordination Group for Mutual Recognition and Decentralised procedures - Human (CMDh). (2017, Feb). CORE SmPC for Hormone Replacement Therapy Products.