Verfahren der assistierten Reproduktionstherapie
Die assistierte Reproduktionstherapie (ART) ist definiert als ärztliche Hilfe zur Erfüllung des Kinderwunsches eines Paares. Die dabei eingesetzten medizinischen Behandlungen und Methoden zur Herbeiführung einer Schwangerschaft umfassen unter anderem die Handhabung der menschlichen Keimzellen oder Embryonen1.
Die am häufigsten angewendeten Verfahren sind
- Insemination,
- In-vitro-Fertilisation (IVF),
- intrazytoplasmatische Spermieninjektion (ICSI) und
- Kryozyklus.
Obwohl nur Paare eingeschränkter Fertilität mittels ART behandelt werden, hat sich gezeigt, dass die Schwangerschaftsraten nach ART in etwa mit denen natürlicher Schwangerschaften übereinstimmen (Abb. 1)2. Dies legt nahe, dass die Fertilitätseinschränkung betroffener Paare durch die ART aufgehoben wird.
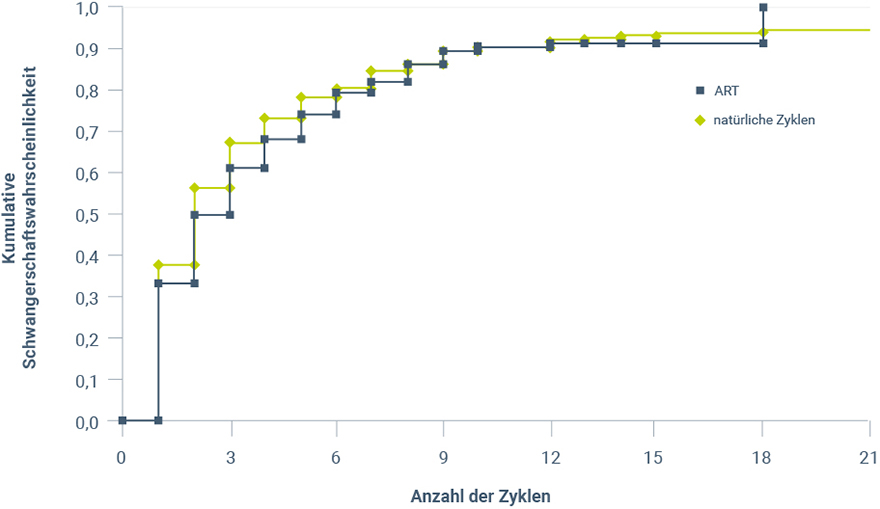
Abbildung 1: Kumulative Schwangerschaftsraten nach ART und in natürlichen Zyklen (modifiziert nach Gnoth et al. 20112).
Epidemiologie
Seit Ende der 1970er Jahre wird die ART bei vielen Paaren mit unerfülltem Kinderwunsch für eine erfolgreiche Initiierung einer Schwangerschaft eingesetzt. Weltweit kamen so bis zum Jahr 2015 insgesamt etwa 5 Millionen Kinder nach einer IVF oder ICSI zur Welt3. Die Anzahl an Behandlungen steigt auch in Deutschland wieder jährlich an, nachdem es im Jahr 2004 einen Einbruch gegeben hatte (Tab. 1).
Tabelle 1: Anzahl an ART-Behandlungen in den Jahren 1982–2016 (modifiziert nach Deutsches IVF Register e. V. 2017 3)
| 1982 | 1986 | 1990 | 2002 | 2003 | 2004 | 2012 | 2013 | 2014 | 2015 | 2016 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| IVF | 742 | 3.806 | 7.343 | 23.936 | 28.058 | 11.848 | 12.047 | 12.569 | 13.675 | 15.105 | 15.476 |
| ICSI | 37.692 | 51.389 | 25.339 | 38.897 | 42.381 | 44.427 | 48.532 | 48.897 | |||
| IVF/ ICSI | 678 | 987 | 446 | 1.014 | 1.142 | 1.178 | 1.194 | 1.214 | |||
| Kryo | 14.923 | 14.265 | 16.883 | 19.293 | 20.633 | 21.893 | 23.226 | 24.842 | |||
| Keine | 9.802 | 11.133 | 4.928 | 6.117 | 6.708 | 7.210 | 11.671 | 13.552 | |||
| Gesamt | 742 | 4.201 | 8.653 | 87.044 | 105.854 | 59.448 | 77.368 | 83.433 | 88.383 | 99.728 | 103.981 |
Werte für die Jahre 1991–2001 und 2005–2011 sind auf der Website des Deutschen IVF Registers zu finden (www.deutsches-ivf-register.de).
Zur ART gehören auch Behandlungen mittels intratubaren Gametentransfers (engl.: gamete intrafallopian transfer = GIFT), die aufgrund einer dabei erforderlichen Laparoskopie seit 2005 nur noch sehr selten durchgeführt werden4.
Gesetzliche Vorgaben
Der Behandlungsrückgang 2004 war die direkte Folge des Gesetzes zur Modernisierung der gesetzlichen Krankenversicherung (GKV-Modernisierungsgesetz) im Jahr 20035. Hierbei wurde den Patienten im Fall einer ART eine Eigenbeteiligung von 50 % der Kosten auferlegt. Mittlerweile hat sich die Situation für die Patienten verbessert und die gesetzlichen Krankenkassen finanzieren teilweise mehr als 50 %. Außerdem können in einigen Bundesländern Zuschüsse beantragt werden. Werden Zuschüsse gewährt, so beteiligt sich der Bund ebenfalls an den Behandlungskosten.
Indikationen für eine ART
Die (Muster-)Richtlinie der Bundesärztekammer zur Durchführung der assistierten Reproduktion aus dem Jahre 2006 wurde im Mai 2018 durch eine komplett neu gefasste Richtlinie der Bundesärztekammer zur Entnahme und Übertragung von menschlichen Keimzellen im Rahmen der assistierten Reproduktion ersetzt1. In der neuen Richtlinie sind die Indikationen des jeweiligen Verfahrens für Deutschland detaillierter definiert (Tab. 2)1.
Tabelle 2: Indikation für eine Insemination, IVF und ICSI (modifiziert nach Bundesärztekammer 20181)
| Verfahren | Indikation |
|---|---|
| Insemination homolog, intrauterin |
|
| Insemination heterolog |
|
| IVF |
|
| ICSI |
|
Wenngleich bei Frauen nach erfolgloser ART eine geringere Lebensqualität festgestellt wurde, scheint diese Erfolglosigkeit das langfristige Wohlergehen der Frauen nicht zu gefährden6. Zudem konnte in aktuellen Studien keine Assoziation zwischen der Entwicklung von Krebs oder auch dem Prader-Willi-Syndrom und einer ART hergestellt werden7,8,9.
Kryokonservierung
Seit Anfang der 1980er Jahre werden Embryonen oder Eizellen kryokonserviert. Hierbei wird die Vitrifikation als Einfrierverfahren bevorzugt, da eine schädigende Eiskristallbildung bei diesem Verfahren vermieden wird10,11. Gründe zur Konservierung sind
- eine anstehende Chemo- oder Strahlentherapie12,
- eine erneute ART nach zuvor erfolgloser Behandlung zur Vermeidung einer erneuten Ovarpunktion und hormoneller Stimulierung sowie
- soziale Faktoren ("social egg freezing")13.
Basiselemente zur Durchführung der ART
Die ART besteht aus den drei Basiselementen
- ovarielle Stimulation,
- Reproduktionstechnik (Insemination, IVF, ICSI, Kryozyklen) und
- Lutealphasenunterstützung.
Ovarielle Stimulation
Das Ziel der ovariellen Stimulation ist ein Anstieg des follikelstimulierenden Hormons (FSH) für eine polyfollikuläre Entwicklung. Die Stimulation der Ovarien kann erfolgen mittels14
- Clomifen,
- FSH und
- humanem Menopausengonadotropin (hMG).
Für die ovarielle Stimulation stehen verschiedene Protokolle zur Verfügung (Abb. 2). Gonadotropin-Releasing-Hormon (GnRH)-Agonisten sowie -Antagonisten werden zunächst zur Unterdrückung der endogenen Gonadotropine eingesetzt. Dadurch wird ein endogener Anstieg des luteinisierenden Hormons (LH) verhindert15, der zur spontanen Rupturierung und Degeneration des Follikels führen kann. Der Einsatz von GnRH-Agonisten startet vor der Stimulation, zum Beispiel in der midlutealen Phase des Vorzyklus18, da die Down-Regulation der hypophysären GnRH-Rezeptoren erst durch die kontinuierliche Verabreichung erreicht wird (Langprotokoll). Die Effizienz der Down-Regulation kann anhand der Suppression des endogenen LH und des endogenen Estradiol vor Beginn der Stimulation überprüft werden18. Hingegen hemmen GnRH-Antagonisten die Ausschüttung der Gonadotropine (FSH, LH) direkt, ihr Einsatz wird in der Regel während der bereits laufenden Stimulation begonnen (Kurzprotokoll). Die finale Eizellreifung wird schließlich mit humanem Choriongonadotropin (hCG) eingeleitet. Die Follikelpunktion und das Absaugen der Oozyten erfolgt nach 36 Stunden16, der Embryotransfer (ET) in den Uterus nach weiteren 48–72 Stunden17 oder erst nach 120 Stunden18.

Abbildung 2: Agonisten- und Antagonisten-Protokoll zur ovariellen Stimulation.
Auch GnRH-Agonisten wurden im Kurzprotokoll eingesetzt. Da sie initial eine verstärkte Gonadotropin-Ausschüttung auslösen ("Flare-Up"), galten sie vor allem als Option für Frauen, deren Eierstöcke schlecht auf Gonadotropine ansprechen ("Poor Responder")19. Ou et al. (2015) demonstrierten in einer retrospektiven Analyse an 5.662 IVF-ET/ICSI-Zyklen, dass das Langprotokoll dem Kurzprotokoll bei Frauen gleichen Alters hinsichtlich Implantations-, Schwangerschaftsraten und Oozytenausbeute (ovarielle Reaktion) überlegen ist18. Interessanterweise wurden in einer systematischen Meta-Analyse zu Kurzprotokollen mit Einsatz von GnRH-Antagonisten bei Poor-Responder-Frauen vergleichbare Schwangerschaftsergebnisse wie für Langprotokolle unter Verwendung von GnRH-Agonisten gezeigt20. Weil mit GnRH-Antagonisten generell geringere Raten an unerwünschten ovariellen Überstimulationen beobachtet wurden, können entsprechende Kurzprotokolle als Methode der ersten Wahl für Poor-Responder-Frauen angesehen werden. Für Frauen, die normal oder gut auf Gonadotropine ansprechen, waren jedoch die Schwangerschaftsraten im Kurzprotokoll mit GnRH-Antagonisten signifikant niedriger im Vergleich zum Langprotokoll mit GnRH-Agonisten20.
Allgemein gelten als prädiktive Faktoren der ovariellen Reaktion21:
- Alter der Frau,
- Anti-Müller-Hormon (AMH)-Spiegel,
- Anzahl der Antralfollikel (engl.: antral follicle count = AFC),
- FSH-Spiegel und
- Länge des Menstruationszyklus.
Nelson et al. (2015) verglichen in einer retrospektiven Analyse zweier multizentrischer Studien die Aussagekraft von AMH und AFC auf die ovarielle Reaktion nach Stimulation22. Sowohl unter Verwendung von GnRH-Agonisten als auch -Antagonisten korrelierte das AMH (r = 0,56) stärker mit der Oozytenausbeute als die AFC (r = 0,28).
Reproduktionstechniken
1. Insemination
Unter Insemination versteht man das Einbringen des Nativspermas in die Zervix (intrazervikale Insemination, ICI) oder des aufbereiteten Spermas in den Uterus (intrauterale Insemination, IUI) bzw. in die Eileiter (intratubare Insemination, ITI)1. Dabei kommt der IUI gemäß Studien die größte Bedeutung zu23,24,25,26.
Die Begleitung der IUI mittels Sonographie ist umstritten. Gemäß Polat et al. (2015) steigert eine von Sonographie begleitete IUI die Schwangerschaftsraten nicht27. Gegensätzlich dazu empfehlen Otzekin et al. (2013) eine Sonographie während der IUI basierend auf den Ergebnissen einer retrospektiven Studie mit erhöhten Schwangerschaftsraten28.
Generell verliert die Insemination jedoch zunehmend an Relevanz. In einem Vergleich von IVF und IUI ermittelten Elzeiny et al. (2014) sowohl höhere Schwangerschaftsraten (40 vs. 12 %) als auch Lebendgeburtenraten (40 vs. 6 %) nach einer IVF29. Darüber hinaus war die IVF kosteneffizienter.
2. In-vitro-Fertilisation
Mit Louise Brown wurde 1978 der erste Mensch nach einer IVF geboren30. Unter IVF, auch als "extrakorporale Befruchtung" bezeichnet, versteht man die Vereinigung einer Eizelle mit einer Samenzelle außerhalb des Körpers der Frau1.
Die IVF läuft wie in Abbildung 3 dargestellt ab.

Abbildung 3: Ablauf einer IVF (modifiziert nach Ludwig 200231).
Trotz der durch Technikfortschritt gegebenen Möglichkeiten, das Endometriumvolumen oder auch den subendometrialen Blutfluss zu untersuchen, werden heute immer noch die Dicke sowie Struktur des Endometriums am häufigsten zur Beurteilung der endometrialen Rezeptivität (ER) herangezogen32. Zur zuverlässigen Beurteilung der ER wurde ferner ein genetischer Test (engl.: endometrial receptivity array = ERA) etabliert33,34. Damit kann anhand von 238 Genen das Implantationsfenster der Frauen individuell bestimmt werden33. Gemäß Ruiz-Alonso et al. (2013) konnten so die Schwangerschaftsraten bei Frauen mit wiederholtem Implantationsversagen durch den mittels ERA personalisierten Embryotransfer erhöht werden35.
Neben medizinischen Gründen für den Abbruch einer IVF, wie z. B. bei vorzeitiger Ovulation, brechen einige Paare die Behandlung freiwillig ab. Die Hauptgründe sind Umfragen zufolge Hoffnungslosigkeit auf Erfolg sowie der psychologische Stress36,37. Auch in der Richtlinie der Bundesärztekammer wurde konstatiert, dass Patienten die Informationen zur psychosozialen Beratung als unzureichend empfinden und den Betroffenen eine weiterführende Beratung durch entsprechend qualifizierte Psychotherapeuten oder psychosoziale Beratungsstellen empfohlen werden sollte1.
3. Intrazytoplasmatische Spermieninjektion
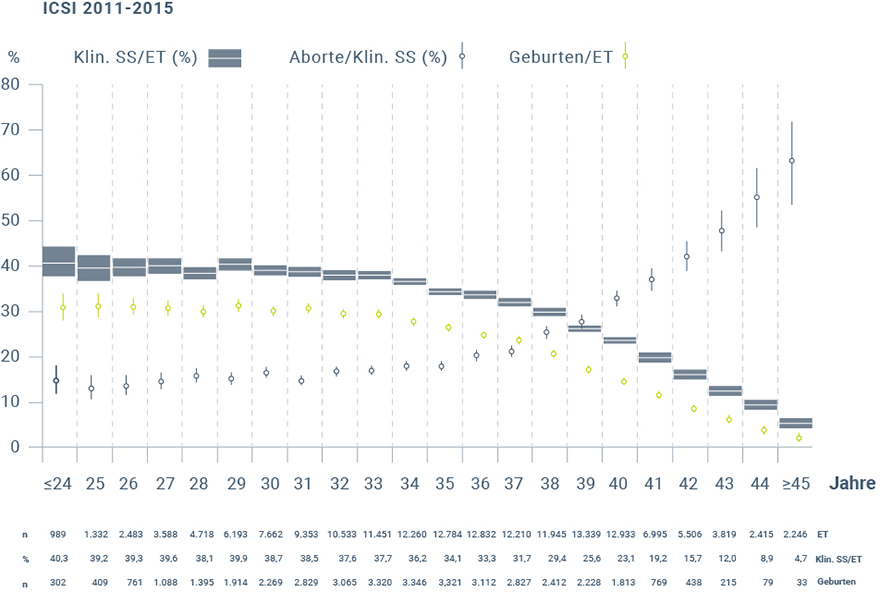
Die ICSI verläuft generell analog zur IVF (Abb. 3), jedoch wird abweichend nur eine Samenzelle direkt in das Zytoplasma der Eizelle injiziert. Bei Paaren mit Kryptozoospermie oder Azoospermie des Mannes werden durch die Kombination einer testikulären Spermienextraktion (TESE) oder mikrochirurgischen epididymalen Spermienaspiration (MESA) mit ICSI (TESE- bzw. MESA-ICSI) die Aussichten auf Erfüllung des Kinderwunsches verbessert und die Geburtenraten erhöht38,39. Liegt der Subfertilität des Paares jedoch kein männlicher Faktor zugrunde, so bleiben die Lebendgeburtenraten von ICSI und IVF vergleichbar40. Wie generell bei IVF steht auch der Erfolg einer ICSI in direktem Zusammenhang mit dem Alter der Frau (Abb. 4)3,41. Demnach sinken die Schwangerschafts- sowie Geburtenraten mit steigendem Alter der Frau, während gleichzeitig die Abortraten zunehmen.
Abbildung 4: Schwangerschaftsraten und -verläufe in Abhängigkeit des Alters der Frau 2010-2015 (modifiziert nach Deutsches IVF Register e. V. 20173). ET = Embryotransfer; SS = Schwangerschaft.
Van Loendersloot et al. (2013) entwickelten auf Grundlage von 2.621 Zyklen bei 1.326 mit ICSI oder IVF behandelten Paaren ein Vorhersagemodell zur Berechnung der Erfolgschancen42. Dieses Modell beinhaltet 13 Variablen, darunter beispielsweise das Alter der Frau und die Dauer der Subfertilität.
4. Kryozyklen
Bei Kryozyklen wird ein Embryo, der vorher als unfertilisierte bzw. fertilisierte Oozyte oder Embryo kryokonserviert wurde, in das Cavum uteri übertragen (engl.: frozen embryo transfer = FET). Einer Meta-Analyse von Roque et al. (2013) zufolge ergeben sich durch FET signifikant höhere Schwangerschaftsraten im Vergleich zum Transfer frischer Embryonen43. Dies basiert vermutlich auf einer besseren Synchronisation zwischen Embryo und Endometrium.
Casper und Yanushpolsky (2016) stellten drei Regime der Führung von Kryozyklen gegenüber, die sie als natürliche, modifiziert natürliche (hCG-Trigger) und programmierte Zyklen bezeichneten (Tab. 3)44. Sie plädierten dafür, dass nicht nur in programmierten, sondern auch in natürlichen Zyklen eine Progesteronergänzung erwogen werden sollte.
Tabelle 3: Drei Regime der Führung von Kryozyklen (modifiziert nach Casper & Yanushpolsky 201644)
| Zyklus | Natürlich | Modifiziert natürlich | Programmiert |
|---|---|---|---|
| Hormone Arzneimittel | ± Progesteron | hCG (als Ovulationstrigger) ± Progesteron nach Embryotransfer | GnRH-Agonist (Zyklusunterdrückung) Estradiol + Progesteron |
| Hormonbestimmungen (LH Serum/Urin, Progesteron Serum) | häufig | häufig | keine/selten |
| Sonographie | häufig | häufig | selten |
| Bemerkung | hCG dient auch als luteale Unterstützung | Embryotransfer flexibel, zeitlich planbar |
Als die beiden häufigsten Varianten wurden "natürliche" Zyklen mit oder ohne hCG-Trigger zur Ovulationsinduktion einerseits und Hormontherapie-Zyklen mit oder ohne GnRH-Agonisten-Suppression andererseits identifiziert45.
Aqha-Hosseini et al. (2018) empfehlen basierend auf den Ergebnissen einer Studie an Frauen mit regulärem Menstruationszyklus einen FET in natürlichen Zyklen, da bei vergleichbaren Schwangerschaftsraten keine Medikation nötig ist. Zudem treten keine unerwünschten Wirkungen auf und die Kosten sind signifikant geringer46.
Lutealphasenunterstützung
Insbesondere bei Zyklen mit polyfollikulärer Entwicklung oder dem Einsatz von GnRH-Agonisten und -Antagonisten entsteht oftmals eine Lutealphaseninsuffizienz47,48. Daher wird seitens der Experten eine hormonale Unterstützung der Lutealphase empfohlen49,50,51. Derzeit gilt die vaginale Anwendung von Progesteron als Hauptform der Unterstützung der Lutealphase52. Insbesondere sollte diese bei Einsatz von Langprotokollen mit Down-Regulation durch GnRH-Agonisten erfolgen, da die hypophysäre LH-Sekretion blockiert bleibt. Auf routinemäßige hCG-Gabe zur Lutealphasenunterstützung wird vielfach verzichtet, da häufiger ovarielle Hyperstimulationssyndrome auftreten53,54,55,56.
-
Bundesärztekammer. Richtlinie zur Entnahme und Übertragung von menschlichen Keimzellen im Rahmen der assistierten Reproduktion. 2018.
-
Gnoth C, Maxrath B, Skonieczny T, Friol K, Godehardt E, Tigges J. Final ART success rates: a 10 years survey. Human Reproduction. 2011;26(8):2239-2246.
-
Deutsches IVF Register (DIR) e. V. DIR Jahrbuch 2016. J Reproduktionsmed Endokrinol. 2017.
-
Padilla SL, Dugan K, Maruschak V, Smith RD, Zinder H. Laparoscopically assisted gamete intrafallopian transfer with local anesthesia and intravenous sedation. Fertility and sterility. 1996;66(3):404-407.
-
GKV-Modernisierungsgesetz (GMG). Gesetz zur Modernisierung der gesetzlichen Krankenversicherung (GKV-Modernisierungsgesetz) vom 14. November 2003 (BGBl. I S. 2190), in Kraft getreten am 1. Januar 2004, zuletzt geändert am 15. Dezember 2004 (BGBl. I S. 3445), in Kraft getreten am 21. Dezember 2004. 2003.
-
Kuivasaari-Pirinen P, Koivumaa-Honkanen H, Hippelainen M, Raatikainen K, Heinonen S. Outcome of assisted reproductive technology (ART) and subsequent self-reported life satisfaction. PloS one. 2014;9(11):e112540.
-
Gold JA, Ruth C, Osann K, et al. Frequency of Prader-Willi syndrome in births conceived via assisted reproductive technology. Genetics in medicine : official journal of the American College of Medical Genetics. 2014;16(2):164-169.
-
Luke B, Brown MB, Spector LG, et al. Cancer in women after assisted reproductive technology. Fertility and sterility. 2015;104(5):1218-1226.
-
Williams CL, Jones ME, Swerdlow AJ, et al. Risks of ovarian, breast, and corpus uteri cancer in women treated with assisted reproductive technology in Great Britain, 1991-2010: data linkage study including 2.2 million person years of observation. BMJ (Clinical research ed.). 2018;362:k2644.
-
Boldt J. Current results with slow freezing and vitrification of the human oocyte. Reproductive biomedicine online. 2011;23(3):314-322.
-
Glujovsky D, Riestra B, Sueldo C, et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. The Cochrane database of systematic reviews. 2014(9):CD010047.
-
Wallace WH, Smith AG, Kelsey TW, Edgar AE, Anderson RA. Fertility preservation for girls and young women with cancer: population-based validation of criteria for ovarian tissue cryopreservation. The Lancet. Oncology. 2014;15(10):1129-1136.
-
Baldwin K, Culley L, Hudson N, Mitchell H. Running out of time: exploring women's motivations for social egg freezing. Journal of psychosomatic obstetrics and gynaecology. 2018:1-8.
-
Jungheim ES, Meyer MF, Broughton DE. Best practices for controlled ovarian stimulation in in vitro fertilization. Seminars in reproductive medicine. 2015;33(2):77-82.
-
Tarlatzis BC, Fauser BC, Kolibianakis EM, Diedrich K, Devroey P, Group OBotBGACW. GnRH antagonists in ovarian stimulation for IVF. Human reproduction update. 2006;12(4):333-340.
-
Madani T, Jahangiri N. Empty Follicle Syndrome: The Possible Cause of Occurrence. Oman Medical Journal. 2015;30(6):417-420.
-
Caspi E, Ron-El R, Golan A, Herman A, Nachum H. Early, late, and sequential embryo transfer in in vitro fertilization program: a preliminary report. Fertility and sterility. 1989;52(1):146-148.
-
Ou J, Xing W, Li Y, Xu Y, Zhou C. Short versus Long Gonadotropin-Releasing Hormone Analogue Suppression Protocols in IVF/ICSI Cycles in Patients of Various Age Ranges. PloS one. 2015;10(7):e0133887.
-
Garcia JE, Padilla SL, Bayati J, Baramki TA. Follicular phase gonadotropin-releasing hormone agonist and human gonadotropins: a better alternative for ovulation induction in in vitro fertilization. Fertility and sterility. 1990;53(2):302-305.
-
Lambalk CB, Banga FR, Huirne JA, et al. GnRH antagonist versus long agonist protocols in IVF: a systematic review and meta-analysis accounting for patient type. Human reproduction update. 2017;23(5):560-579.
-
Oehninger S, Nelson SM, Verweij P, Stegmann BJ. Predictive factors for ovarian response in a corifollitropin alfa/GnRH antagonist protocol for controlled ovarian stimulation in IVF/ICSI cycles. Reproductive biology and endocrinology : RB&E. 2015;13:117.
-
Nelson SM, Klein BM, Arce JC. Comparison of antimullerian hormone levels and antral follicle count as predictor of ovarian response to controlled ovarian stimulation in good-prognosis patients at individual fertility clinics in two multicenter trials. Fertility and sterility. 2015;103(4):923-930.e921.
-
Hurd WW, Randolph JF, Jr., Ansbacher R, Menge AC, Ohl DA, Brown AN. Comparison of intracervical, intrauterine, and intratubal techniques for donor insemination. Fertility and sterility. 1993;59(2):339-342.
-
Goldberg JM, Mascha E, Falcone T, Attaran M. Comparison of intrauterine and intracervical insemination with frozen donor sperm: a meta-analysis. Fertility and sterility. 1999;72(5):792-795.
-
Carroll N, Palmer JR. A comparison of intrauterine versus intracervical insemination in fertile single women. Fertility and sterility. 2001;75(4):656-660.
-
Allahbadia GN. Intrauterine Insemination: Fundamentals Revisited. Journal of obstetrics and gynaecology of India. 2017;67(6):385-392.
-
Polat I, Ekiz A, Yildirim G, et al. Ultrasound-guided intrauterine insemination versus blind intrauterine insemination: a randomized controlled trial. Clinical and experimental obstetrics & gynecology. 2015;42(5):657-662.
-
Oztekin D, Ozcinar E, Kose C, Gulhan I, Ozeren M, Tinar S. The use of ultrasound during intrauterine insemination in unexplained infertility may improve pregnancy outcomes. Medical principles and practice : international journal of the Kuwait University, Health Science Centre. 2013;22(3):291-294.
-
Elzeiny H, Garrett C, Toledo M, Stern K, McBain J, Baker HWG. A randomised controlled trial of intra-uterine insemination versus in vitro fertilisation in patients with idiopathic or mild male infertility. Australian and New Zealand Journal of Obstetrics and Gynaecology. 2014;54(2):156-161.
-
Niederberger C, Pellicer A. Introduction: IVF's 40th world birthday. Fertility and sterility. 2018;110(1):4.
-
Ludwig M. Techniken der Reproduktionsmedizin. Aktueller Stand und Zukunft. Der Gynäkologe. 2002;35(12):1253-1266.
-
Mahajan N, Sharma S. The endometrium in assisted reproductive technology: How thin is thin? Journal of Human Reproductive Sciences. 2016;9(1):3-8.
-
Garrido-Gomez T, Ruiz-Alonso M, Blesa D, Diaz-Gimeno P, Vilella F, Simon C. Profiling the gene signature of endometrial receptivity: clinical results. Fertility and sterility. 2013;99(4):1078-1085.
-
Miravet-Valenciano JA, Rincon-Bertolin A, Vilella F, Simon C. Understanding and improving endometrial receptivity. Current opinion in obstetrics & gynecology. 2015;27(3):187-192.
-
Ruiz-Alonso M, Blesa D, Diaz-Gimeno P, et al. The endometrial receptivity array for diagnosis and personalized embryo transfer as a treatment for patients with repeated implantation failure. Fertility and sterility. 2013;100(3):818-824.
-
Rajkhowa M, McConnell A, Thomas GE. Reasons for discontinuation of IVF treatment: a questionnaire study. Human reproduction (Oxford, England). 2006;21(2):358-363.
-
Lande Y, Seidman DS, Maman E, Baum M, Hourvitz A. Why do couples discontinue unlimited free IVF treatments? Gynecological endocrinology : the official journal of the International Society of Gynecological Endocrinology. 2015;31(3):233-236.
-
Kang YN, Hsiao YW, Chen CY, Wu CC. Testicular sperm is superior to ejaculated sperm for ICSI in cryptozoospermia: An update systematic review and meta-analysis. Scientific reports. 2018;8(1):7874.
-
Erdem E, Karacan M, Cebi Z, Ulug M, Arvas A, Camlibel T. Results of Intracytoplasmic sperm injection (ICSI) performed with sperm retrieved by microscopic testicular sperm extraction (m-TESE) in azoospermic patients. Turkish journal of urology. 2018:1-5.
-
Li Z, Wang AY, Bowman M, et al. ICSI does not increase the cumulative live birth rate in non-male factor infertility. Human reproduction (Oxford, England). 2018;33(7):1322-1330.
-
Cimadomo D, Fabozzi G, Vaiarelli A, Ubaldi N, Ubaldi FM, Rienzi L. Impact of Maternal Age on Oocyte and Embryo Competence. Frontiers in endocrinology. 2018;9:327.
-
van Loendersloot LL, van Wely M, Repping S, Bossuyt PM, van der Veen F. Individualized decision-making in IVF: calculating the chances of pregnancy. Human reproduction (Oxford, England). 2013;28(11):2972-2980.
-
Roque M, Lattes K, Serra S, et al. Fresh embryo transfer versus frozen embryo transfer in in vitro fertilization cycles: a systematic review and meta-analysis. Fertility and sterility. 2013;99(1):156-162.
-
Casper RF, Yanushpolsky EH. Optimal endometrial preparation for frozen embryo transfer cycles: window of implantation and progesterone support. Fertility and sterility. 2016;105(4):867-872.
-
Ghobara T, Gelbaya TA, Ayeleke RO. Cycle regimens for frozen-thawed embryo transfer. The Cochrane database of systematic reviews. 2017;7:CD003414.
-
Agha-Hosseini M, Hashemi L, Aleyasin A, et al. Natural cycle versus artificial cycle in frozen-thawed embryo transfer: A randomized prospective trial. Turkish journal of obstetrics and gynecology. 2018;15(1):12-17.
-
Tavaniotou A, Albano C, Smitz J, Devroey P. Comparison of LH concentrations in the early and mid-luteal phase in IVF cycles after treatment with HMG alone or in association with the GnRH antagonist Cetrorelix. Human reproduction (Oxford, England). 2001;16(4):663-667.
-
Tavaniotou A, Devroey P. Effect of human chorionic gonadotropin on luteal luteinizing hormone concentrations in natural cycles. Fertility and sterility. 2003;80(3):654-655.
-
Tavaniotou A, Smitz J, Bourgain C, Devroey P. Comparison between different routes of progesterone administration as luteal phase support in infertility treatments. Human reproduction update. 2000;6(2):139-148.
-
Penzias AS. Luteal phase support. Fertility and sterility. 2002;77(2):318-323.
-
van der Gaast MH, Beckers NG, Beier-Hellwig K, Beier HM, Macklon NS, Fauser BC. Ovarian stimulation for IVF and endometrial receptivity--the missing link. Reproductive biomedicine online. 2002;5 Suppl 1:36-43.
-
Yanushpolsky, EH. (2015). Luteal phase support in in vitro fertilization. Seminars in reproductive medicine. 33(2):118-127.
-
Posaci, C., et al. (2000). Progesterone for the luteal support of assisted reproductive technologies: clinical options. Human reproduction (Oxford, England). 15 Suppl 1:129-148
-
Ugur M, Yenicesu O, Ozcan S, Keles G, Gokmen O. A prospective randomized study comparing hCG, vaginal micronized progesterone and a combination regimen for luteal phase support in an in-vitro fertilization programme. Fertility and sterility. 2001;76(3):118.
-
McClure, N., et al. (1992). Luteal phase support and severe ovarian hyperstimulation syndrome. Human reproduction (Oxford, England). 7(6):758-764.
-
Belaisch-Allart, J., et al. (1990). The effect of HCG supplementation after combined GnRH agonist/HMG treatment in an IVF programme. Human reproduction (Oxford, England). 5(2):163-166.