Anzeichen urogenitaler Beschwerden
Durch einen anhaltenden Estrogenmangel kommt es zu atrophischen Veränderungen im Genitalbereich, die Haut wird dünner, trockener und verliert ihre Elastizität. Am atrophierten Epithel wird gramnegativen Bakterien (hauptsächlich Darmbakterien) die Besiedelung erleichtert, sodass Vaginal- und Harnwegsinfektionen entstehen können.
Symptome des urogenitalen Menopausensyndroms (engl.: genitourinary syndrome of menopause = GSM)
Die Bezeichnung „urogenitales Menopausensyndrom (GSM)“ wurde als Begriff eingeführt, um die durch die hypoestrogenen Bedingungen verursachten und häufig in Kombination auftretenden Beschwerden der vulvovaginalen und urogenitalen Atrophie unter einem Syndrom zusammenzufassen. Es betrifft über 50 % der postmenopausalen Frauen1.
Das GSM zeichnet sich durch verschiedene Symptome und Anzeichen aus, die mit dem zunehmenden Estrogenmangel und Absinken anderer Sexualsteroidkonzentrationen verbunden sind. Es umfasst Veränderungen im Bereich der Labia majora/minora, der Klitoris, des Vestibulum/Introitus vaginae, der Vagina, der Urethra und der Harnblase. Das GSM kann Symptome im genitalen Bereich hervorrufen (wie Scheidentrockenheit, Brennen und Irritationen), Einschränkungen in der Sexualität durch fehlende Feuchtigkeitsbildung (wie Unbehagen/Schmerz und sexuelle Dysfunktion) oder den Harnapparat betreffende Symptome (wie überaktive Blase, Dysurie und rezidivierende Harnwegsinfekte)2.
Von folgenden Beschwerden berichten Frauen mit GSM3:
- Scheidentrockenheit (100 %)
- Dyspareunie (78 %)
- Brennen (57 %)
- Juckreiz (57 %)
- Dysurie (36 %)
Vulvovaginale Veränderungen in den Wechseljahren
Sowohl Vagina und Vulva als auch Introitus und Epithel der Urethra und Blase weisen bei der jüngeren Frau eine hohe Dichte an Estrogenrezeptoren auf. Unter zunehmendem Estrogenmangel in den Wechseljahren verdünnt sich das Epithel der Scheidenwand erheblich bis auf wenige Zelllagen bei starker vaginaler Atrophie. Das Gewebe verliert zudem die Fähigkeit, Wasser zu speichern. Die Fettdepots der großen Labien werden allmählich abgebaut, der Bindegewebsanteil nimmt ab, womit eine fühlbare Volumenverringerung der Schamlippen einhergeht4. Trockenheit der Scheide ist ein Leitsymptom, das bei unbehandelten postmenopausalen Frauen in 30–40 % der Fälle auftritt5 und oft zu Schmerzen beim Geschlechtsverkehr (Dyspareunie) führen kann26. In einer Umfrage gaben ca. 17 % der befragten Frauen im Alter von 40 bis 80 Jahren an, unter Lubrikationsproblemen zu leiden. Rund 10 % klagten über schmerzhaften Geschlechtsverkehr27.
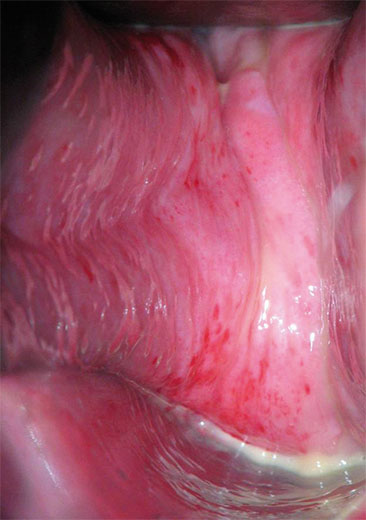
Kommt eine entzündliche Komponente hinzu, so treten vermehrt Symptome wie Brennen, Jucken oder auch Fluor in Erscheinung. Bei einer ausgeprägten atrophischen Kolpitis stellt sich bei der vaginalen Untersuchung das Epithel der Scheidenwand dünn, blass oder gerötet, trocken und mitunter fast durchsichtig dar. Die Gewebeelastizität nimmt deutlich ab, die Rugae verstreichen und es liegt ein Fluor mit reichlich Leukozyten vor. Petechien sind als Zeichen der Empfindlichkeit gegenüber mechanischer Belastung zu werten (Abb. 1). Eine ausgeprägte atrophische Kolpitis geht mit einem hohen Leidensdruck einher. Schmerzen beim Gehen und Dyspareunie sind neben gelblichem Ausfluss charakteristisch6.
Eine Atrophie des Scheidenepithels ist bei bis zu zwei Dritteln der Frauen, die sich seit 4 oder mehr Jahren in der Postmenopause befinden, nachweisbar4,7. In einer multinationalen Befragung von 4.246 postmenopausalen Frauen unter Verwendung eines strukturierten Fragebogens gaben länderabhängig bis zu 40 % der Frauen behandlungsbedürftige Symptome im Zusammenhang mit Scheidenatrophie an, wobei der Einfluss auf die Lebensqualität durchaus unterschiedlich war. Dieser lag in den skandinavischen Ländern bei über 60 %, im UK, den USA und Kanada dagegen teilweise deutlich unter 50 %. Etwa die Hälfte der an der Befragung teilnehmenden Frauen mit Symptomen der vaginalen Atrophie bewertete diese als mittelstark bis stark. Trotzdem hatten etwa 70 % dieser Frauen nicht mit dem behandelnden Arzt darüber gesprochen8.
Klinische Anzeichen der vaginalen Atrophie
Im Verlauf der Atrophie verstreichen die vaginalen Falten, die Scheidenhaut erscheint damit glatt, zudem wirkt sie trocken, dünner und „durchscheinend“. Häufig zeigen sich beider Spekulumuntersuchung oder im Kolposkop Petechien und Ekchymosen9.
Darüber hinaus ist ein Anstieg des pH-Wertes, der bei einer estrogenisierten Vagina normalerweise im mäßig sauren Bereich (pH 3,5–4,5) liegt, in den schwach sauren bis eher neutralen Bereich (pH 5,0–7,0) zu verzeichnen. Dadurch wird das Wachstum nicht scheidentypischer und pathogener Mikroorganismen unterstützt, sodass die Anfälligkeit für Infektionen wie etwa der bakteriellen Vaginose oder (rezidivierender) Harnwegsinfekte mit Geruchsbildung erhöht ist10.
Als weiteres klinisches Zeichen einer vaginalen Atrophie gilt die Veränderung des vaginalen Reifungsindex. Dieser gibt den relativen Anteil der Oberflächenzellen im Vergleich zu intermediären und parabasalen Zellen an und bildet den lokalen Estrogenstatus ab. Im Falle einer vaginalen Atrophie in der Postmenopause verändert sich der Index zugunsten der Intermediärzellen und vor allem der Parabasalzellen11.
Vulvovaginale Atrophie bei Anwenderinnen oraler Kontrazeptiva
In Deutschland sind orale Kontrazeptiva die am meisten verbreitete Verhütungsmethode. Dabei werden vor allem niedrig dosierte, kombinierte Estrogen-Gestagen-Präparate angewendet. Unter der Einnahme dieser oralen Kontrazeptiva können lokale Hormonmangelerscheinungen im Urogenitalbereich auftreten28. Die wesentliche Ursache dafür liegt in der Unterdrückung der endogenen Estrogenproduktion. Die verabreichte geringe Dosis an Ethinylestradiol führt mitunter zu einer unzureichenden Estrogenisierung im Beckenbodenbereich, sodass die regenerativen Prozesse im Urogenitaltrakt nicht aufrechterhalten werden.
Oft treten Introitusbeschwerden (v. a. Dyspareunie) nach einer Scheidenpilzinfektion mit Candida albicans auf. Die Pilzinfektion geht mit einer verstärkten Abschilferung von Zellen einher, wodurch die Scheiden- und Introitushaut deutlich dünner wird. Die lokale Estrogenwirkung der oralen Kontrazeptiva kann zu schwach sein, um das relativ dünne Vaginalepithel nach einer Pilzinfektion wieder ausreichend aufzubauen. Die Scheidenhaut bleibt dünn und es kann zu Beschwerden wie Brennen und Rhagadenbildung bei Geschlechtsverkehr sowie rezidivierenden Pilzinfektionen kommen. Für die Behandlung der vaginalen Trockenheit und Atrophie, die durch die Einnahme oraler Kontrazeptiva bedingt ist, wird die vaginale Anwendung von estriolhaltigen Präparaten empfohlen29. Auch die Anwendung estrogenfreier Präparate kann in Betracht gezogen werden.
Welche weiteren urogenitalen Symptome treten vor allem in den Wechseljahren auf?
Auch die unteren Harnwege sind mit zunehmendem Lebensalter häufig vom Estrogenmangel betroffen. Eine Rückbildung der Schleimhaut von Harnröhre und Blasenhals kann auch hier mit entzündlichen Veränderungen im Sinne einer atrophischen Urethritis/Urethrozystitis einhergehen. Diese wiederum erleichtert das Auftreten einer Harninkontinenz und rezidivierender Harnwegsinfektionen12,13,14.
Die weibliche Harninkontinenz ist eine häufige und für die betroffene Patientin sehr einschränkende Erkrankung. Nicht selten führt die Harninkontinenz zur Abnahme der sozialen Kontakte und damit auch zu einer Verschlechterung der Lebensqualität. Epidemiologische Untersuchungen wiesen nach, dass die Häufigkeit des ungewollten Urinverlustes mit zunehmendem Alter ansteigt15.
Estrogene stimulieren den hormonabhängigen Zellzyklus in der Harnröhrenschleimhaut wie auch im Blasenepithel16. Sie erhöhen darüber hinaus den Blutfluss in der Submukosa der Harnröhre sowie im Harnröhrensphinkter17. Estrogene bewirken eine verstärkte Proliferation der Harnröhrenschleimhaut und fördern die periurethrale Durchblutung. Beide Komponenten sind zusammen mit der Sphinktermuskulatur am Aufbau des Urethraldrucks beteiligt. Estrogene verstärken den urethralen Verschlussdruck, verbessern die abdominale Druckübertragung auf die Urethra und stimulieren die periurethrale Kollagensynthese. Auch scheinen sie den sensorischen Schwellenwert für die Blasenentleerung zu erhöhen18,19. Sie sensibilisieren die α-Adrenozeptoren des Harnröhrensphinkters20 und stimulieren den Umsatz des periurethralen Bindegewebes.
Schwankungen des Estrogenblutspiegels können daher im Erwachsenenalter durchaus einen messbaren Einfluss auf Funktionsparameter der unteren Harnwege haben. So können zyklische Schwankungen in urologischen Symptomen während des Menstruationszyklus durch Messung des Harnröhrendruckprofils objektiv dargestellt werden21. Auch funktionelle und anatomische Länge der Urethra schwanken über den Zyklus. Die größte Länge ergibt sich mittzyklisch und in der frühen Lutealphase und korreliert somit mit der Höhe der Estrogenblutspiegel22.
Aufgrund der anatomischen Gegebenheiten mit kurzer Harnröhre und unmittelbarer Nähe zu Vagina und After sind die ableitenden Harnwege der Frau anfälliger für Keimbesiedelung und Infektionen, als dies beim Mann der Fall ist. Veränderungen der Vaginalflora in der Postmenopause erhöhen das Risiko für Harnwegsinfektionen, insbesondere bei sexuell aktiven Frauen. Diese Erkenntnis wurde bereits in den 1970er-Jahren publiziert23.
Im Bereich der unteren Harnwege und des Beckenbodens wirken Estrogene über Estrogenrezeptoren, die sich in den Epithelien der Urethra, des Blasenhalses (insbesondere des Trigonum vesicae) sowie im Beckenbodengewebe (Muskulatur und Bindegewebsstrukturen) und im Halteapparat befinden. Die Stimulierung der Rezeptoren führt zu einer verstärkten Proliferation des Harnröhrenepithels und fördert auch die periurethrale Durchblutung sowie die Kollagensynthese im Bereich des Beckenbodens. Unter Estrogeneinfluss bildet das Scheidenepithel Glykogen, die Voraussetzung für eine Döderleinflora mit Milchsäureproduktion und saurem Scheidenmilieu24.
Bei Estrogenmangel fehlt das Substrat für die Laktobazillen, die die Vagina natürlich besiedeln und es kommt es zu einem Anstieg des pH-Wertes. Dadurch wird die Besiedelung der Scheide, aber auch des Introitus mit überwiegend gramnegativen Stäbchenbakterien (meist coliforme) erleichtert. E. coli ist der am häufigsten nachgewiesene Keim (bis zu 80 % der Fälle). Proteus, Klebsiellen und Enterobakter machen zusammen mit verschiedenen Enterokokken nur 5–10 % der Fälle aus25.
-
Gandhi, J., et al. (2016, Dec). Genitourinary syndrome of menopause: an overview of clinical manifestations, pathophysiology, etiology, evaluation, and management. Am J Obstet Gynecol, 215(6), pp. 704-11.
-
Neves-E-Castro, et al. (2015, May). EMAS position statement: The ten point guide to the integral management of menopausal health. Maturitas, 81(1), pp. 88-92.
-
Palma, F., et al. (2016, Jan). Vaginal atrophy of women in postmenopause. Results from amulticentric observational study: The AGATA study. Maturitas, 83, pp. 40-4.
-
van Geelen, J., van de Weijer, P., & Arnolds, H. (2000). Urogenital symptoms and resulting discomfort in non-institutionalized Dutch women aged 50-75 years. Int Urogynecol J Pelvic Floor Dysfunct, 11(1), pp. 9-14.
-
Stenberg, A., Heimer, G., Ulmsten, U., & Cnattingius, S. (1996, May). Prevalence of genitourinary and other climacteric symptoms in 61-year-old women. Maturitas, 24, pp. 31-6.
-
Stadberg, E., Mattsson, L., & Milsom, I. (1997, May). The prevalence and severity of climacteric symptoms and the use of different treatment regimens in a Swedish population. Acta Obstet Gynecol Scand, 76(5), pp. 442-8.
-
Dennerstein, L., Dudley, E., Hopper, J., & Guthrie, J. B. (2000, Sep). A prospective population-based study of menopausal symptoms. Obstet Gynecol, 96(3), pp. 351-8.
-
Nappi, R., & Kokot-Kierepa, M. (2010, Nov). Women's voices in the menopause: results from an international survey on vaginal atrophy. Maturitas, 67(3), pp. 233-8.
-
Stute, P., & Kiesel, L. (2007). Lokale Östrogentherapie in der Menopause. Gynäkol Endokrinol, 5, S. 150-6.
-
Caillouette, J., Sharp, C. J., Zimmerman, G., & Roy, S. (1997, Jun). Vaginal pH as a marker for bacterial pathogens and menopausal status. Am J Obstet Gynecol, 176(6), pp. 1270-5.
-
Birtalan, I. (1999). Estring – eine neue lokale Östrogentherapie bei vaginaler und urogenitaler Atrophie. J für die Menopause, 6, pp. 17-21.
-
Cardozo, L., Benness, C., & Abbott, D. (1998, Apr). Low dose oestrogen prophylaxis for recurrent urinary tract infections in elderly women. Br J Obstet Gynaecol, 105(4), pp. 403-7.
-
Robinson, D., & Cardozo, L. (2003, Mar). The menopause and HRT. Urogenital effects of hormone therapy. Best Pract Res Clin Endocrinol Metab, 17(1), pp. 91-104.
-
Dessole, S., et al. (2004, Jan-Feb). Efficacy of low-dose intravaginal estriol on urogenital aging in postmenopausal women. Menopause, 11(1), pp. 49-56.
-
Viereck, V., et al. (Apr 2000). Urogenitales Altern. Reproduktionsmed, 16(2), S. 90-102.
-
Blakeman, P., Hilton, P., & Bulmer, J. (1996). Estrogen status and cell cycle activity in the female lower urinary tract. Neurourol Urodyn, 15, pp. 325-6.
-
Versi, E., & Cardozo, L. (1986). Urethral instability: diagnosis based on variations in the maximum urethral pressure in normal climacteric women. Neurourol Urodyn, 5, pp. 535-41.
-
Jackson, S., et al. (1996). The effect of estradiol on vaginal collagen in postmenopausal women with stress urinary incontinence. Neurourol Urodyn, 15, pp. 327-8.
-
Fantl, J. (1998). Postmenopausal urinary incontinence: comparison between non-estrogen and estrogen supplemented women. Obstet Gynecol, 71, pp. 823-8.
-
Screiter, F., Fuchs, P., & Stockamp, K. (1976). Estrogenic sensitivity of alpha receptors in the urethral musculature. Urol Int, 31, pp. 13-9.
-
Van Geelen, J., Doesburg, W., Thomas, C., & Martin, C. J. (1981, Oct). Urodynamic studies in the normal menstrual cycle: the relationship between hormonal changes during the menstrual cycle and the urethral pressure profile. Am J Obstet Gynecol, 141(4), pp. 384-92.
-
Hextall, A., & Cardozo, L. (2001). The role of estrogen supplementation in lower urinary tract dysfunction. Int Urogynecol J Pelvic Floor Dysfunct, 12(4), pp. 258-61.
-
Marshall, S., & Linfoot, J. (1977, Jun). Influence of hormones on urinary tract infection. Therapeutic implications. Urology, 9(6), pp. 675-9.
-
Yoshimura, T., & Okamura, H. (2001, Sep). Short term oral estriol treatment restores normal premenopausal vaginal flora to elderly women. Maturitas, 39(3), pp. 253-7.
-
Petri, E. (2000). Harnwegsinfektionen. In E. Petri (Hrsg.), Gynäkologische Urologie (S. 195-212). Stuttgart, New York: Thieme.
-
Sturdee, D., Panay, N., & Society, i. N. (2010). Empfehlungen zum Vorgehen bei postmenopausaler vaginaler Atrophie, 1. Oktober 2010. J Gynäkol Endokrinol, 13(4), S. 8-21.
-
Laumann, E., et al. (2005, Jan-Feb). Sexual problems among women and men aged 40-80 y: prevalence and correlates identified in the Global Study of Sexual Attitudes and Behaviors. Int J Impot Res, 17(1), pp. 39-57.
-
De Leo, V., Caruso, S., Scolaro, V., & Cianci, A. (2009, Oct). Low dose oral contraceptives: 30 microg are still used? Minerva Ginecol, 61(5), pp. 453-8.
-
Mares, P., Hoffet, M., Rousseau, O., & Ripart-Neveu, S. (2001, Jan). Vaginal dryness. Rev Prat, 51(2), pp. 155-8.