
Unerfüllter Kinderwunsch
Gemäß Definition der World Health Organization (WHO) spricht man von Infertilität, falls sich bei einem Paar trotz regelmäßigen ungeschützten Geschlechtsverkehrs innerhalb eines Jahres keine Schwangerschaft einstellt1. Weltweit liegt die Prävalenz der Infertilität bei Frauen im Median bei 9 % (3,5–16,7 %)2.
Infertilität kann anhand der Anzahl erfolgloser Zyklen in unterschiedliche Subfertilitätsgrade unterteilt werden (Tab. 1). Demnach gelten Paare mit Kinderwunsch nach 6 erfolglosen Zyklen als leicht subfertil3. Betroffen davon sind zirka 20 % der Paare und nur jedes zweite dieser Paare wird in den nächsten 6 Zyklen ein Kind zeugen. Die verbleibenden 10 % sind hingegen von erheblicher Subfertilität betroffen, von denen wiederum nur 50 % spontan in den nächsten 36 Monaten konzipieren werden. Nach 48 erfolglosen Monaten gelten Paare als definitiv infertil mit nur sporadischen Aussichten auf eine Spontankonzeption.
Tabelle 1: Prävalenz und Definition von Subfertilität und Infertilität anhand der Anzahl erfolgloser Zyklen (modifiziert nach Gnoth et al. 20053)
| Anzahl erfolgloser Zyklen | Betrifft | Perspektive |
|---|---|---|
| Nach 6 erfolglosen Zyklen | Zirka 20 % leicht subfertile Paare | 50 % Spontankonzeption in den nächsten 6 Zyklen |
| Nach 12 erfolglosen Zyklen | Zirka 10 % erheblich subfertile Paare | 50 % Spontankonzeption in den nächsten 36 Monaten |
| Nach 48 Monaten | Zirka 5 % definitiv infertile Paare | Nur sporadische Aussichten auf Spontankonzeption |
Ziller et al. (2013) schätzten, dass in Deutschland zwischen den Jahren 2006 und 2010 8,9 % der Frauen im Alter zwischen 18 und 45 Jahren als subfertil (definiert als ICD-10: N97 und ICD-10: Z31) diagnostiziert wurden4. Ein unerfüllter Kinderwunsch und die Selbstidentifikation als infertil können für die Frauen und Männer individuell als auch für das Paar insgesamt eine extreme emotionale Belastung darstellen5,6,7.
Ursachen und Risikofaktoren
Die Ursachen für einen unerfüllten Kinderwunsch sind vielfältig und verteilen sich zu etwa gleichen Teilen auf beide Geschlechter (Abb. 1).

Abbildung 1: Verteilung der Ursachen für Sub- und Infertilität (modifiziert nach Brugo-Olmedo et al. 20018).
Gemäß der Analyse einer repräsentativen Kohorte von mehr als 60.000 als subfertil diagnostizierten Frauen wird die Wahrscheinlichkeit einer Schwangerschaft erheblich beeinträchtigt durch9
- das Alter,
- eine Endometriose,
- Diabetes mellitus,
- eine ovarielle Dysfunktion,
- ein polyzystisches Ovar-Syndrom (PCOS) und
- eine vorausgegangene Entzündung des Urogenitaltraktes.
Der Lebensstil hat ebenfalls einen großen Einfluss auf die Fertilität, wobei als fertilitätseinschränkende Risikofaktoren gelten10
- ein hoher Nikotinkonsum,
- Alkoholabusus,
- Bewegungsmangel,
- die bisher verwendete Verhütungsmethode,
- viele sexuell übertragbare Krankheiten,
- Unter- oder Mangelernährung und
- Adipositas.
Das reproduktive Potential
Die Wahrscheinlichkeit der Spontankonzeption eines Paares wird als reproduktives Potential bezeichnet. Ausschlaggebend dafür und für die damit einhergehende Fertilität sind11
- das Alter der Frau,
- die ovarielle Reserve,
- die Anzahl erfolgloser Zyklen und
- die Qualität des Spermiogramms.
Alter der Frau und ovarielle Reserve
Die Erfüllung des eigenen Kinderwunsches hat sich in den letzten Jahrzehnten bei Frauen zu einem späteren Lebenszeitpunkt hin verschoben12. Die Folge des zunehmenden Alters ist ein Anstieg von Risikoschwangerschaften, denn gemäß der "Mutterschafts-Richtlinien" 2016 des Gemeinsamen Bundesausschusses werden Schwangerschaften ab 35 Jahren automatisch als Risikoschwangerschaft bewertet13. Grund hierfür ist beispielsweise das erhöhte Risiko der Frauen für die Entwicklung eines Gestationsdiabetes, einer Präeklampsie, einer Placenta praevia, einer postpartalen Blutung oder einer Frühgeburt14,15.
Mit steigendem Alter der Frau spielt bei der Subfertilität die ovarielle Reserve zudem eine entscheidende Rolle. Diese beschreibt den Anteil entwicklungsfähiger Primordialfollikel. Einer Datenmodellierung von Wallace & Kelsey (2010) zufolge hat die ovarielle Reserve zum Zeitpunkt der Menarche im Vergleich zur Geburt (100 %) bereits um 1/3 abgenommen (Abb. 2)16.

Abbildung 2: Altersabhängige ovarielle Reserve der Frau (modifiziert nach Wallace & Kelsey 201016).
Bei 95 % der Frauen liegt die ovarielle Reserve im Alter von 30 Jahren bei 12 %, ab 40 Jahren verbleiben nur noch 3 % der Primordialfollikel16. Zudem korreliert das Alter der Frau mit einer geringeren Qualität der Eizellen17,18 und einer sinkenden Implantationsrate, während gleichzeitig die Wahrscheinlichkeit für Aneuploidie steigt19.
Anzahl erfolgloser Zyklen
Die Anzahl erfolgloser Zyklen stellt einen wichtigen Aspekt des reproduktiven Potentials dar20. Je größer die Anzahl erfolgloser Zyklen, desto geringer ist die Wahrscheinlichkeit einer Spontankonzeption (Abb. 3)10. Auch hier spielt das Alter der Frau eine wichtige Rolle. Während die Wahrscheinlichkeit einer Spontankonzeption bei einer 25-jährigen Frau nach 6 erfolglosen Zyklen bei zirka 0,15 liegt, so beträgt die einer 40-jährigen Frau nur zirka 0,05.
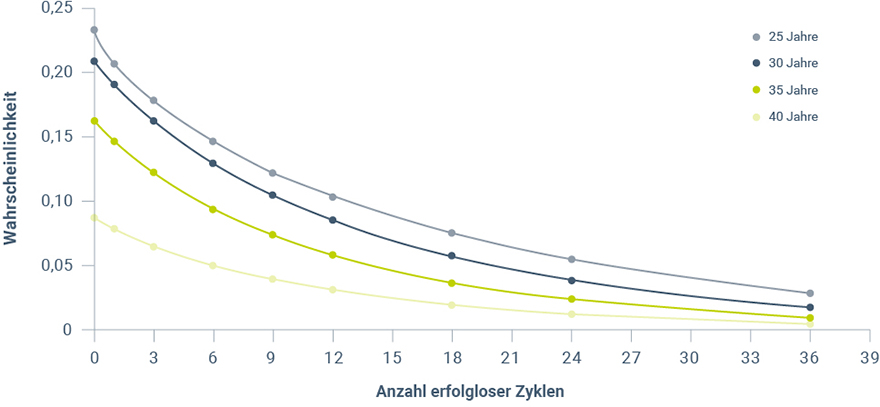
Abbildung 3: Wahrscheinlichkeit der Spontankonzeption im nächsten Zyklus abhängig von Anzahl erfolgloser Zyklen und Alter der Frau (modifiziert nach Gnoth 201710).
Zirka 5 % aller Paare mit Kinderwunsch bleiben auch nach 48 Monaten erfolglos3. Vor allem in Anbetracht des steigenden Alters der Frauen mit Kinderwunsch ist der Zeitraum von 48 Monaten sehr lang. Daher sollten Diagnostik und Therapie gerade bei Frauen über 35 Jahren bereits nach 6 erfolglosen Zyklen erfolgen.
Das Spermiogramm
Der Mann beeinflusst das reproduktive Potential des Paares generell durch die Qualität seiner Spermien. Die Beurteilung des Spermiogramms ist daher ein wesentlicher Bestandteil einer Fertilitätsuntersuchung.
Diagnostische Optionen
Üblicherweise werden Fertilitätsuntersuchungen erst durchgeführt, wenn nach einem Jahr ungeschützten regelmäßigen Geschlechtsverkehrs keine Schwangerschaft eingetreten ist. Die frühzeitigere Untersuchung des Paares nach 6 erfolglosen Zyklen sollte jedoch in Betracht gezogen werden bei Frauen21
- ab einem Alter über 35 Jahre,
- mit vorausgegangenen ektopen Schwangerschaften,
- mit bekannten Erkrankungen der Eileiter,
- mit Beckenentzündungen oder sexuell übertragbaren Krankheiten in der Anamnese,
- mit Amenorrhöen oder Oligomenorrhöen,
- mit vorausgegangenen Operationen an Tuben oder am Becken oder
- mit Myomen
sowie bei Männern mit21
- vorausgegangenen Operationen am Urogenitaltrakt,
- Hodenmissbildungen oder Orchidopexien,
- vorausgegangenen Chemo- oder Strahlentherapien,
- anamnestisch sexuell übertragbaren Krankheiten oder
- Varikozelen.
Untersuchungen bei Frauen
Bei Diagnosestellung von Frauen wird vor allem auf Ovulationsstörungen, ovarielle Reserve, Gebärmutteranomalien und Tubenobstruktionen getestet, die mit einer Infertilität assoziiert sein können. Zervikale Faktoren spielen ebenfalls eine Rolle, wobei die Beurteilung des Zervixschleims jedoch recht unzuverlässig und diese Untersuchung damit nicht aussagekräftig ist22.
Eine umfassende Anamnese sollte frühere Kontrazeptionsmethoden, Regelmäßigkeit des Menstruationszyklus, Schwangerschaften, Beckeninfektionen, Medikamenteneinnahmen, berufliche Exposition, Operationen an Geschlechtsorganen und die Einnahme von Drogen, Alkohol oder Tabak enthalten23. Neben einer endokrinen und gynäkologischen Untersuchung sind die Früherkennung und Impfung auf vermeidbare Krankheiten, wie Röteln, Varizellen, sexuell übertragbare Infektionen und Gebärmutterhalskrebs, ebenfalls sinnvoll.
Bei infertilen Frauen werden zu zirka 40 % Ovulationsstörungen beobachtet24. Diese manifestieren sich häufig als Menstruationsstörung. Demgegenüber stellt eine Eumenorrhö gemäß Malcolm & Cumming (2003) einen präzisen Marker für die Ovulation dar25, sodass die Zykluskontrolle zur Diagnose verwendet wird. Ferner sollten die Frauen mit Menstruationsstörungen auf Ursachen wie PCOS, thyreoidale Erkrankungen oder auch Hyperprolaktinämie hin untersucht werden. Abgesehen von der Zykluskontrolle werden Messungen der Basaltemperatur, Konzentrationsbestimmungen des luteinisierenden Hormons (LH) im Urin (LH-Teststreifen), Serumbestimmungen von Progesteron während der Lutealphase oder Endometriumbiopsien zur Untersuchung von Ovulationsstörungen genutzt, wobei die Aussagekraft limitiert sein kann26,27,28,29.
Die ovarielle Reserve kann unter anderem mittels Serumspiegel des follikelstimulierenden Hormons (FSH) an Zyklustag 330, Clomifen-Test und Sonographie ermittelt werden24. Die Bestimmung des Anti-Müller-Hormons (AMH) gilt derzeit jedoch als der beste Test zur Abschätzung der ovariellen Reserve31.
Mit einer Hysterosalpingographie oder Chromopertubation werden das Uterusgewebe sowie die Tubendurchgängigkeit untersucht. In einer Studie mit 38 Frauen zeigten Exacoustos et al. (2003), dass die Ergebnisse beider Methoden zu zirka 90 % übereinstimmten32.
Kavitäre Anomalien, wie z. B. ein Uterus septus, können mittels Sonographie erkannt werden. Gleichzeitig können Informationen über die Anzahl an Antralfollikeln gewonnen werden. Eine vollständige Beurteilung der Gebärmutterhöhle erfordert insbesondere auch eine Sonohysterographie, beispielsweise zur Detektion von Uteruspolypen oder des Asherman-Syndroms33.
Die Laparoskopie stellt mittlerweile eine Reserveuntersuchung für Frauen mit unerklärter Infertilität oder Hinweisen auf eine Endometriose dar24.
Untersuchungen bei Männern
Die Infertilität des Mannes ist bei etwa 30 % der Paare die einzige Ursache eines unerfüllten Kinderwunsches34. Die Beurteilung der männlichen Fertilität umfasst die Anamnese, eine körperliche Untersuchung und die Ejakulatanalyse.
Wichtige anamnestische Parameter sind eine Vorvaterschaft, ein Kryptorchismus, medizinische und chirurgische Eingriffe, sexuelle Dysfunktion und die Einnahme von Medikamenten, Tabak, Alkohol oder Drogen. Bei der körperlichen Untersuchung können Hodenanomalien wie eine Varikozele oder das Fehlen der Samenleiter auffällig sein.
Die Ejakulatanalyse des Mannes ist trotz ihrer Limitationen die wichtigste Methode zur Untersuchung der Fertilität35. Zur Definition von Referenzbereichen für Spermienanzahl, Morphologie und Motilität in einer Ejakulatprobe wurden durch die Analyse von Ejakulaten von ≥ 4.500 Männern in 14 Ländern die Werte ermittelt36. Eine abnorme Ejakulatanalyse sollte nach mindestens einem Monat unter Einhaltung der Richtlinien der WHO wiederholt werden37.
Die bei einer Ejakulatanalyse untersuchten Parameter sind zwar mit der Spermienfunktion assoziiert, allerdings tragen weitere Faktoren zur Befruchtungsfähigkeit der Spermien bei. Demnach können Paare auch spontan trotz auffälliger Spermiogramme (z. B. Asthenozoospermie oder Oligozoospermie) der Männer konzipieren38. Die Ejakulatanalyse allein ist deshalb nicht präzise genug zur Vorhersage der Fertilität. Weiterführende Tests wie eine Hodenbiopsie, genetische Tests und bildgebende Verfahren sind in Einzelfällen indiziert39.
Der Postkoital-Test – früher integraler Bestandteil bei Fertilitätsuntersuchungen – ist umstritten und wird heute nicht mehr empfohlen24. In zwei Studien wurden eine schlechte Korrelation zwischen der postkoitalen Spermienmotilität und dem Eintritt einer Schwangerschaft40 sowie eine schlechte Reproduzierbarkeit festgestellt41.
-
Zegers-Hochschild F, Adamson GD, de Mouzon J, et al. (2009). International Committee for Monitoring Assisted Reproductive Technology (ICMART) and the World Health Organization (WHO) revised glossary of ART terminology, 2009. Fertil Steril. 92(5), pp. 1520-4.
-
Boivin J, Bunting L, Collins JA, Nygren KG. (2007). International estimates of infertility prevalence and treatment-seeking: potential need and demand for infertility medical care. Hum Reprod. 22(6), pp. 1506-12.
-
Gnoth C, Godehardt E, Frank-Herrmann P, Friol K, Tigges J, Freundl G. (2005). Definition and prevalence of subfertility and infertility. Hum Reprod. 20(5), pp. 1144-7.
-
Ziller V, Hadji P, Thielscher C, Ziller M, Kostev K. (2013). Prevalence of female subfertility in German gynecological practices. Gynecol Endocrinol. 29(8), pp. 767-70.
-
Greil AL, McQuillan J, Lowry M, Shreffler KM. (2011). Infertility treatment and fertility-specific distress: A longitudinal analysis of a population-based sample of U.S. women. Soc Sci Med. 73(1), pp. 87-94.
-
Jacob MC, McQuillan J, Greil AL. (2007). Psychological distress by type of fertility barrier. Hum Reprod. 22(3), pp. 885-94.
-
Fisher JRW, Hammarberg K. (2012). Psychological and social aspects of infertility in men: an overview of the evidence and implications for psychologically informed clinical care and future research. Asian J Androl. 14(1), pp. 121-9.
-
Brugo-Olmedo S, Chillik C, Kopelman S. (2001). Definition and causes of infertility. Reprod Biomed Online. 2(1), pp. 41-53.
-
Ziller V, Heilmaier C, Kostev K. (2015). Time to pregnancy in subfertile women in German gynecological practices: analysis of a representative cohort of more than 60,000 patients. Arch Gynecol Obstet. 291(3), pp. 657-62.
-
Gnoth C. (2017). Kinderwunsch ist meist erfüllbar. MMW Fortschr Med. 159(2), pp. 56-62.
-
Gnoth C. (2013). Natürliche Fertilität eines Paares und epidemiologische Aspekte der Subfertilität. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 56(12), pp. 1633-41.
-
Dietl J. (2001). Geburtenentwicklung: Weiterer Rückgang zu erwarten. Dtsch Arztebl International. 98(19), pp. 1053-5.
-
Gemeinsamer Bundesausschuss. (2016). Richtlinien des Gemeinsamen Bundesausschusses über die ärztliche Betreuung während der Schwangerschaft und nach der Entbindung („Mutterschafts-Richtlinien“). Available from: www.g-ba.de/downloads/62-492-1223/Mu-RL_2016-04-21_iK-2016-07-20.pdf (Access on 30.07.2018).
-
Jolly M, Sebire N, Harris J, Robinson S, Regan L. (2000). The risks associated with pregnancy in women aged 35 years or older. Hum Reprod. 15(11), pp. 2433-7.
-
Lamminpaa R, Vehvilainen-Julkunen K, Gissler M, Selander T, Heinonen S. (2016). Pregnancy outcomes in women aged 35 years or older with gestational diabetes - a registry-based study in Finland. J Matern Fetal Neonatal Med. 29(1), pp. 55-9.
-
Wallace WH, Kelsey TW. (2010). Human ovarian reserve from conception to the menopause. PLoS One. 5(1), pp. e8772.
-
Rambags BP, van Boxtel DC, Tharasanit T, Lenstra JA, Colenbrander B, Stout TA. (2014). Advancing maternal age predisposes to mitochondrial damage and loss during maturation of equine oocytes in vitro. Theriogenology. 81(7), pp. 959-65.
-
Barragan M, Pons J, Ferrer-Vaquer A, et al. (2017). The transcriptome of human oocytes is related to age and ovarian reserve. Mol Hum Reprod. 23(8), pp. 535-48.
-
Munné S, Sandalinas M, Escudero T, et al. (2003). Improved implantation after preimplantation genetic diagnosis of aneuploidy. Reprod Biomed Online. 7(1), pp. 91-7.
-
Gnoth C, Godehardt D, Godehardt E, Frank‐Herrmann P, Freundl G. (2003). Time to pregnancy: results of the German prospective study and impact on the management of infertility. Hum Reprod. 18(9), pp. 1959-66.
-
Taylor A. (2003). ABC of subfertility. Making a diagnosis. Bmj. 327(7413), pp. 494-7.
-
American Society for Reproductive Medicine. (2012). Diagnostic evaluation of the infertile female: a committee opinion. Fertil Steril. 98(2), pp. 302-7.
-
Lindsay TJ, Vitrikas KR. (2015). Evaluation and treatment of infertility. Am Fam Physician. 91(5), pp. 308-14.
-
American Society for Reproductive Medicine. The clinical relevance of luteal phase deficiency: a committee opinion. Fertility and sterility. 2012;98(5):1112-1117.
-
Malcolm CE, Cumming DC. (2003). Does anovulation exist in eumenorrheic women? Obstet Gynecol. 102(2), pp. 317-8.
-
Coutifaris, C., et al. (2004, Nov). Histological dating of timed endometrial biopsy tissue is not related to fertility status. Fertil Steril, 82(5), pp. 1264-72.
-
Quaas A, Dokras A. (2008). Diagnosis and Treatment of Unexplained Infertility. Rev Obstet Gynecol. 1(2), pp. 69-76.
-
Howards PP, Schisterman EF, Wactawski-Wende J, Reschke JE, Frazer AA, Hovey KM. (2009). Timing Clinic Visits to Phases of the Menstrual Cycle by Using a Fertility Monitor: The BioCycle Study. Am J Epidemiol. 169(1), pp. 105-12.
-
Alliende ME, Arraztoa JA, Guajardo U, Mellado F. (2018). Towards the Clinical Evaluation of the Luteal Phase in Fertile Women: A Preliminary Study of Normative Urinary Hormone Profiles. Front Public Health. 6, pp. 147.
-
Scott RT, Toner JP, Muasher SJ, Oehninger S, Robinson S, Rosenwaks Z. (1989). Follicle-stimulating hormone levels on cycle day 3 are predictive of in vitro fertilization outcome. Fertil Steril. 51(4), pp. 651-4.
-
Broer SL, Broekmans FJM, Laven JSE, Fauser BCJM. (2014). Anti-Müllerian hormone: ovarian reserve testing and its potential clinical implications. Hum Reprod Update. 20(5), pp. 688-701.
-
Exacoustos C, Zupi E, Carusotti C, Lanzi G, Marconi D, Arduini D. (2003). Hysterosalpingo-contrast sonography compared with hysterosalpingography and laparoscopic dye pertubation to evaluate tubal patency. J Am Assoc Gynecol Laparosc. 10(3), pp. 367-72.
-
Roma Dalfo A, Ubeda B, Ubeda A, et al. (2004). Diagnostic value of hysterosalpingography in the detection of intrauterine abnormalities: a comparison with hysteroscopy. AJR Am J Roentgenol. 183(5), pp. 1405-9.
-
Kolettis PN. (2003). Evaluation of the subfertile man. Am Fam Physician. 67(10), pp. 2165-72.
-
Wang C, Swerdloff RS. (2014). Limitations of Semen Analysis as a Test of Male Fertility and Anticipated Needs from Newer Tests. Fertility and sterility. 102(6), pp. 1502-7.
-
Cooper TG, Noonan E, von Eckardstein S, et al. (2010). World Health Organization reference values for human semen characteristics. Hum Reprod Update. 16(3), pp. 231-45.
-
World Health Organization. (2010). WHO laboratory manual for the Examination and processing of human semen. Available from: apps.who.int/iris/bitstream/handle/10665/44261/9789241547789_eng.pdf;jsessionid=77FF51F97D340308AFA9B38A9AC20BA9 (Access on 30.07.2018).
-
Matorras R, Diez J, Corcostegui B, et al. (1996). Spontaneous pregnancy in couples waiting for artificial insemination donor because of severe male infertility. Eur J Obstet Gynecol Reprod Biol. 70(2), pp. 175-8.
-
Hofherr SE, Wiktor AE, Kipp BR, Dawson DB, Van Dyke DL. (2011). Clinical diagnostic testing for the cytogenetic and molecular causes of male infertility: the Mayo Clinic experience. J Assist Reprod Genet. 28(11), pp. 1091-8.
-
Collins JA, So Y, Wilson EH, Wrixon W, Casper RF. (1984). The postcoital test as a predictor of pregnancy among 355 infertile couples. Fertil Steril. 41(5), pp. 703-8.
-
Glatstein IZ, Best CL, Palumbo A, Sleeper LA, Friedman AJ, Hornstein MD. (1995). The reproducibility of the postcoital test: a prospective study. Obstet Gynecol. 85(3), pp. 396-400.

