Welche Wirkungen hat eine HRT auf den Kohlenhydrat- und Lipidmetabolismus?
Eine Hormonersatztherapie kann den Kohlenhydrat- und Lipidstoffwechsel beeinflussen. Beispielsweise wird das „gute“ Cholesterin HDL im Serum erhöht und das Risiko an Diabetes-Typ-II zu erkranken erniedrigt. Manche Auswirkungen auf den Stoffwechsel hängen allerdings von der Applikationsroute des Estrogens oder der Wahl des Gestagens ab.
Wirkung einer Hormontherapie auf den Lipidmetabolismus
In der Zeit nach der Menopause kann es mit einer Zunahme des Körperfettes zu einer unvorteilhaften Veränderung des Lipidprofils im Serum kommen1. Der Anteil an HDL-Cholesterin nimmt ab und jener von LDL-Cholesterin und von Gesamtcholesterin nimmt zu2,3. Generell wird durch eine Substitution mit Estrogenen das HDL-Cholesterin erhöht und das LDL- sowie Gesamtcholesterin vermindert4.
Transdermale versus orale Anwendung
Hinsichtlich der Wirkungen einer Hormontherapie auf den Lipidstoffwechsel gibt es Unterschiede, die von der Applikationsart der Behandlung abhängig sind. Bei der oralen Hormontherapie mit Estrogenen kommt es neben einer Abnahme von LDL-Cholesterin und einer Zunahme von HDL-Cholesterin auch zu einem Anstieg der Triglyzeride im Serum3,41. Ein Triglyzerid-Anstieg gilt als kardiovaskulärer Risikofaktor; auch werden unter oraler Estrogentherapie die LDL-Partikel kleiner und dichter und weisen damit wahrscheinlich ein stärkeres atherogenes Potenzial auf42,43.
Auch die Wirkungen auf das Serumlipidprofil unterscheiden sich bei den Anwendungsformen: Bei einer perkutanen Estradiolsubstitution konnten vorteilhafte Effekte auf das Serumlipidprofil beobachtet werden44,45,46. Diese treten im Vergleich zur oralen Estrogensubstitution protrahierter ein und sind meist auch diskreter ausgeprägt. Langfristig können aber Gesamtcholesterin und die LDL-Fraktion gesenkt werden. Eine Steigerung der Triglyzeridspiegel findet unter der transdermalen Anwendung im Gegensatz zur oralen Substitution nicht statt3.
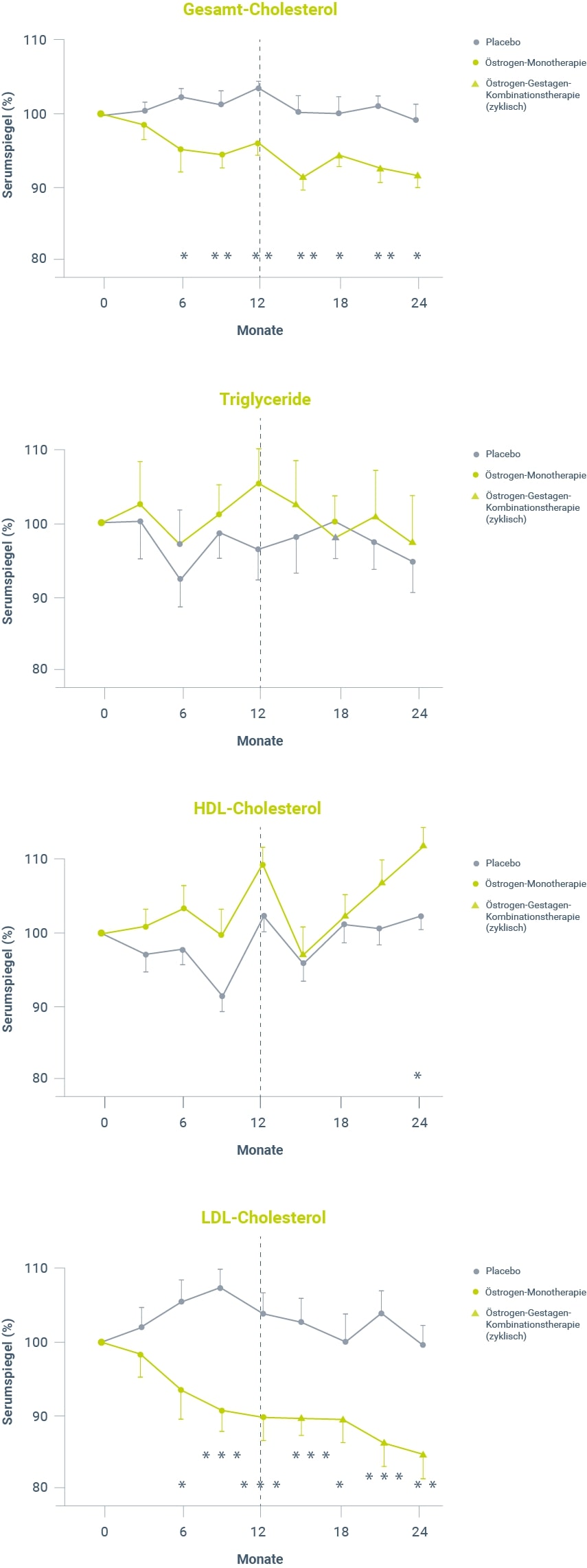
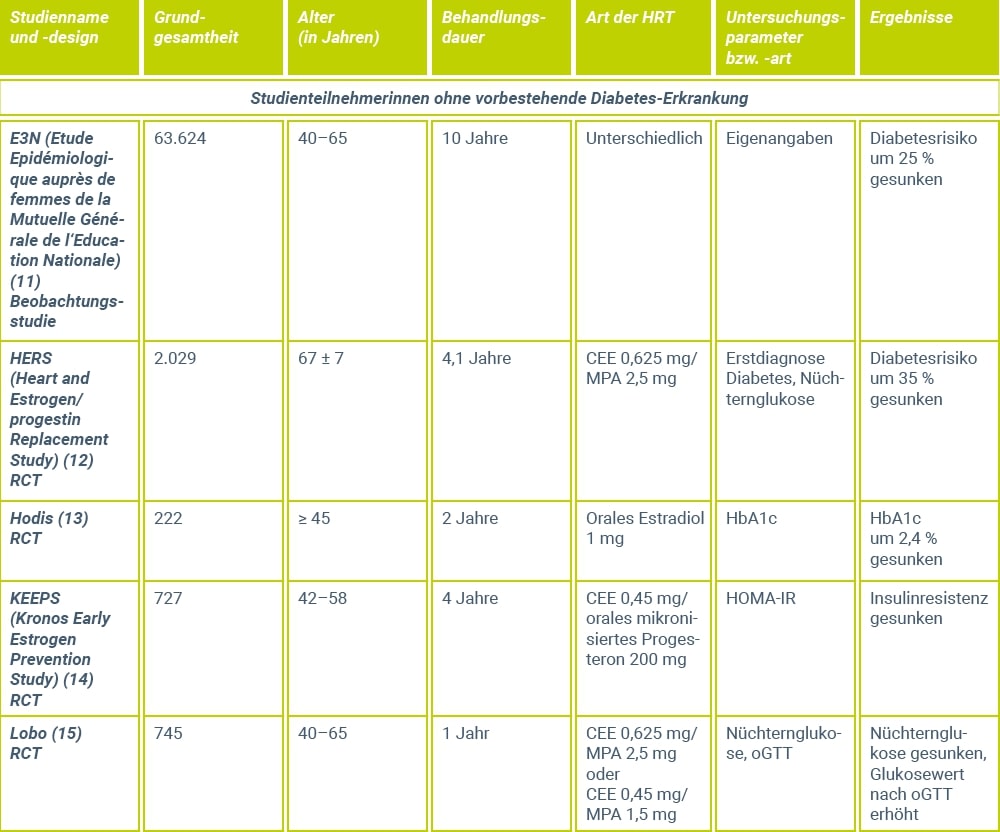
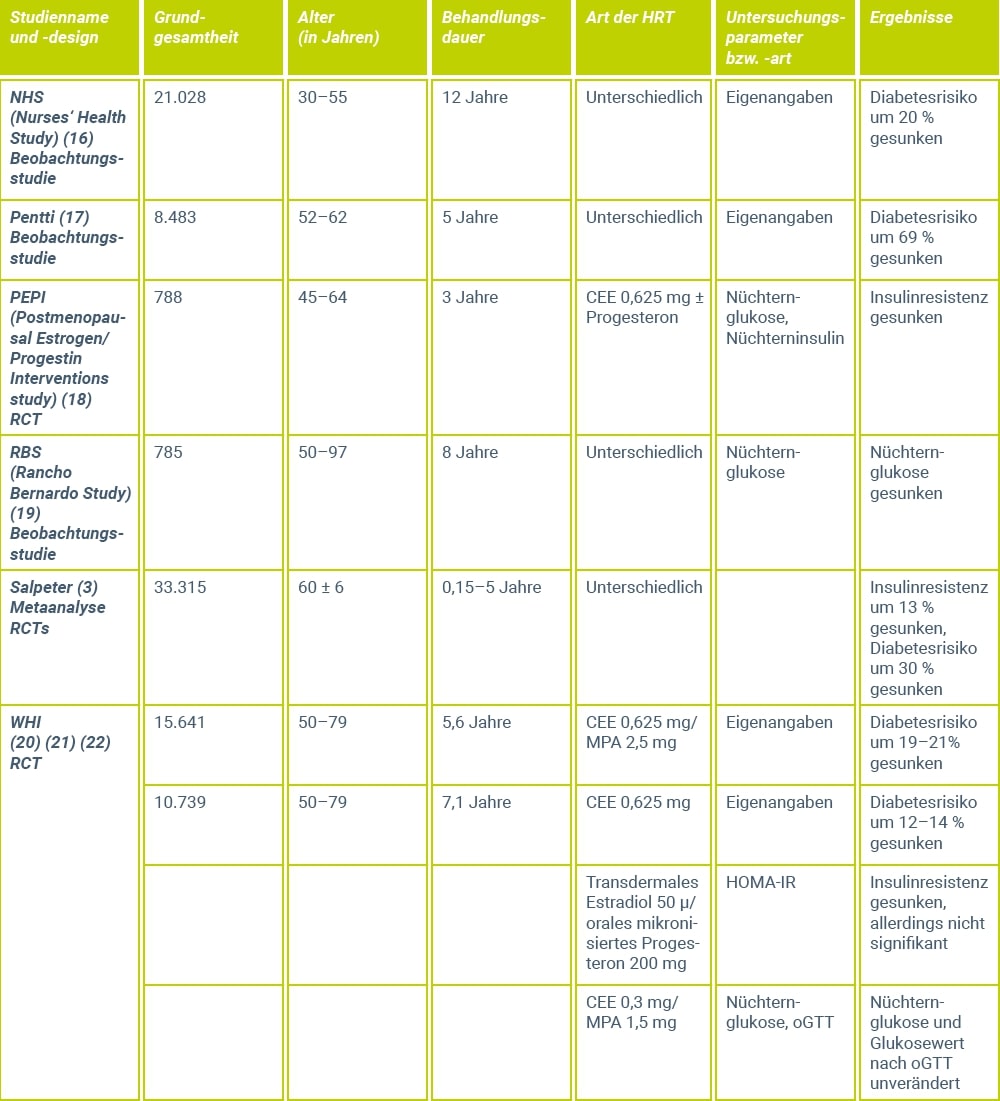
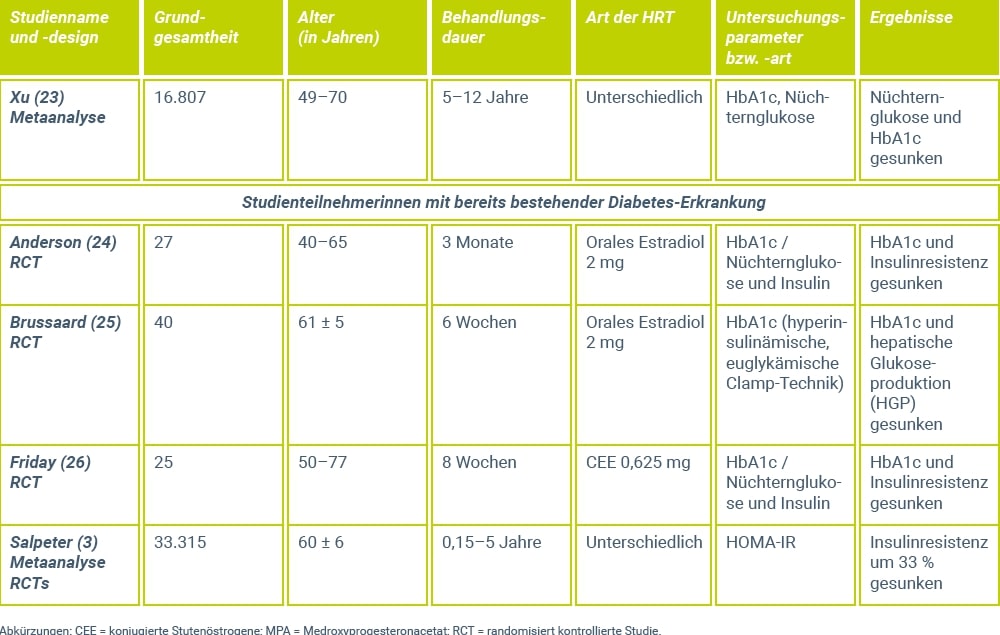
Wie eine placebokontrollierte Untersuchung von Jensen et al.46 belegt, bleiben bei Langzeitanwendung eines Estradiol-Gels, selbst in der maximalen Tagesdosis von 3 mg Estradiol, die Triglyzeridspiegel sowie die HDL-Cholesterin-Fraktion auch bei einer Substitutionsdauer von 2 Jahren praktisch konstant, wohingegen das Gesamtcholesterin und die LDL-Fraktion gegenüber Placebo signifikant gesenkt wurden (Abb. 1). Der Zusatz von mikronisiertem Progesteron über jeweils 12 Tage eines 25-Tage-Behandlungszyklus hatte hierauf keinen Einfluss.
Abbildung 1: Verhalten der Lipid- und Lipoproteinserumspiegel während der Behandlung mit einer Estrogen-Monotherapie, einer zyklischen Estrogen-Gestagen-Kombinationstherapie und Placebo46. Als Estrogen wurde ein Estradiol-Gel und als Gestagen wurde mikronisiertes Progesteron verwendet. Die Mittelwerte und Standardfehler sind als prozentuale Änderung gegenüber dem jeweiligen Ausgangswert angegeben. Signifikante Unterschiede gegenüber der Placebogruppe: * p < 0,05 / ** p < 0,01 / *** p < 0,001.
Konjugierte equine Estrogenen (CEE) versus Estradiol
Eine Metaanalyse von Pu et al.47 hat zu den unterschiedlichen Effekten einer Hormontherapie mit Estradiol oder CEE acht Studien ausgewertet48,49,50,51,52,53,54,55. Es stellte sich heraus, dass mit Anwendung von CEE die HDL-Spiegel höher und die LDL-Spiegel erniedrigt sind. Bei einer Behandlung mit Estradiol waren dafür der diastolische Blutdruck und die Triglycerid-Spiegel signifikant niedriger als bei CEE.
Wahl des Gestagens
Die derzeit in Kombination mit Substitutionsdosen von Estrogenen bei postmenopausalen Frauen angewendeten Gestagene führen gewöhnlich zu einer Reduktion der HDL41,56,57,58. Diese Wirkung hängt wahrscheinlich mit Veränderungen der hepatischen Lipase-Aktivität zusammen59 und wird als potenziell schädlich angesehen60,61,62. Studien zeigten, dass die Behandlung mit oralem mikronisiertem Progesteron allein63 oder zusätzlich zu einer Estrogentherapie41,56,64 geringere Veränderungen des HDL-Cholesterin-Metabolismus verursachte als synthetische Gestagene wie MPA, NET oder Norgestrel.
Kohlenhydratmetabolismus und Typ-II-Diabetes im Zusammenhang mit einer HRT
Für die Prävention des Typ-II-Diabetes gelten gleiche Grundsätze wie für die Prävention kardiovaskulärer Erkrankungen5. Auch bei Personen mit bereits existentem Diabetes ist ein vordringliches Behandlungsziel die Reduktion des erhöhten kardiovaskulären Risikos6. Dazu gehört die Anpassung von Faktoren wie Blutzucker (< 7 % HbA1c), Blutdruck (Zielwert < 140/85 mmHg) und Blutfetten (Zielwert bei hohem kardiovaskulären Risiko: LDL-Cholesterin < 100 mg/100 ml)6, aber auch Lebensstilanpassung wie Nikotinabstinenz, Gewichtskontrolle, Ernährung und Sport.
Auch wenn die Prävention von Typ-II-Diabetes kein primärer Endpunkt in den meisten prospektiven Studien darstellte, sprechen große randomisierte kontrollierte, sowie epidemiologische Studien für einen positiven Effekt einer HRT auf die Glukosehomöostase7,8 (Tab. 1). Trotz dieser Ergebnisse wird ihr Einsatz insgesamt nicht zur Primärprävention von Diabetes empfohlen9,10.
Tabelle 1: Verschiedene Studienergebnisse zum Effekt einer menopausalen Hormontherapie auf das Diabetes-Typ-II-Risiko (modifiziert nach Mauvais-Jarvis et al. 2017)7
In HERS (Heart and Estrogen/progestin Replacement Study)27 wurde das Risiko, dass im Studienverlauf ein Diabetes neu diagnostiziert wird, signifikant um 35 % vermindert12. Insbesondere wurde durch die Hormonanwendung der weitere Anstieg des Nüchternblutzuckers im Studienverlauf vermieden, der unter Placebo zu beobachten war.
In gleicher Weise war bei Einsatz der gleichen oralen Kombination aus konjugierten Stutenestrogenen (CEE) und dem Gestagen Medroxyprogesteronacetat (MPA) in der WHI-Studie das Diabetes-Risiko signifikant um 21 % vermindert21. Bei Frauen, die die Studienmedikation zuverlässig einnahmen, war die signifikante Reduktion des Diabetes-Risikos mit 33 % stärker ausgeprägt. Im Estrogen-Arm der WHI betrug die Abnahme des Diabetes-Risikos insgesamt 12 %; bei den Frauen mit zuverlässiger Hormonanwendung jedoch signifikante 27 %22. In beiden Armen der WHI war das verminderte Diabetes-Risiko mit einer erhöhten Insulinsensitivität verbunden, bestimmt anhand jeweils signifikanter Reduktionen des HOMA-IR21,22. Dies bedeutete auch, dass die jeweiligen signifikanten Verminderungen des Nüchternblutzuckers von signifikanten Reduktionen des Nüchterninsulins begleitet waren28,29.
Eine Metaanalyse von 107 Studien aus dem Jahr 2006 zeigte eine um 13 % verminderte Insulinresistenz (HOMA-IR; 95%-KI 17,1–8,6) und eine Reduktion neu diagnostizierter Diabetes-Fälle um 30 % (95%-KI 0,6–0,9)3.
Ähnliche Beobachtungen legte eine Metaanalyse von Studien, die zwischen 1997 und 2011 publiziert wurden, dar. Als Zusammenfassung wurde geschätzt, dass eine Estrogen-Gestagen-Therapie die Inzidenz für Typ-II-Diabetes um fast 40 % reduziert, mit geringeren Nüchternglukose- und Hämoglobin-A1c-Spiegeln23.
Auch bei neueren randomisierten, kontrollierten Studien wie der KEEPS-14 und der ELITE-Studie30 wurde eine Reduktion der Insulinresistenz oder des glykierten Hämoglobins (HbA1c) bei postmenopausalen Frauen ohne Diabetes festgestellt.
Orale versus transdermale Anwendung
Die positiven Effekte auf den Blutzuckerhaushalt wurden sowohl bei transdermaler als auch bei oraler Anwendung von Estrogenen dokumentiert3,7,11. Die orale Anwendung scheint allerdings stärkere Effekte hervorzurufen. Dies ist vermutlich auf den First-Pass-Effekt zurückzuführen, wodurch eine bessere Suppression der hepatischen Glukoseproduktion erfolgt und durch eine erhöhte SHBG-Produktion die Konzentration an freiem Testosteron abnimmt, was mit einem erhöhten Risiko für Typ-II-Diabetes assoziiert wurde7,31,32,33.
In der derzeit größten Studie (KEEPS), in der die beiden Anwendungsformen direkt verglichen wurden, konnte allerdings im Gegensatz dazu nur mit der transdermalen Anwendung von Estradiol und nicht der oralen Einnahme von konjugierten Stutenestrogenen eine Senkung der Insulinresistenz und der Serum-Insulinkonzentration dokumentiert werden<14. Ein Grund hierfür könnte die im Vergleich zur WHI- und HERS-Studie geringere Dosierung von CEE in der KEEPS-Studie (0,45 mg) sein.
Wahl des Gestagens
Die meisten randomisierten kontrollierten Studien zeigten bei zusätzlicher Gabe eines Gestagens einen abschwächenden Effekt der positiven Stoffwechselwirkungen von Estrogenen7. Allerdings ist hierbei die Wahl des Gestagens sowie dessen Dosierung entscheidend. Insbesondere MPA scheint den positiven Effekt von Estrogenen auf die Glukose-Homöostase zu verringern34. Für Norethisteronacetat sind die Daten weniger eindeutig35,36,37. Es scheint entweder neutral zu sein oder bei höheren Konzentrationen den Estrogeneffekt leicht abzuschwächen. Progesteron zeigte bei alleiniger Anwendung keinen Einfluss auf die Nüchtern-Glukose-Werte38 und wirkt dem positiven Effekt der Estrogene nicht entgegen39.
In der prospektiven E3N-EPIC-Kohortenstudie wurde auch das Diabetesrisiko in Abhängigkeit von der Art der HRT inklusive der verschiedenen Gestagentypen untersucht11. Es wurden 63.624 postmenopausale Frauen ohne bekannten Diabetes zu Studienbeginn, die am Anfang der Untersuchung zwischen 40 und 65 Jahre alt waren, über im Mittel 10,4 Jahre beobachtet. Dabei wurden in 663.087 Personenjahren 1.220 Fälle eines neu aufgetretenen Typ-II-Diabetes erfasst. Frauen, die eine HRT anwendeten oder angewendet hatten, wiesen ein um 25 % signifikant vermindertes Diabetesrisiko auf, wenn die Veränderung des BMI im Studienverlauf berücksichtigt wurde. Hinsichtlich spezifischer Estrogen-Gestagen-Kombinationen ergab sich jedoch nur mit transdermalem Estrogen plus Progesteron eine signifikante Reduktion des Diabetes-Risikos (RR 0,67; 95%-KI 0,54–0,84) bei hinreichendem Expositionsumfang (112 Fälle bei 7.725 exponierten Frauen). Es konnte allerdings auch kein signifikanter Unterschied zwischen den verschiedenen Gestagenen gezeigt werden.
HRT bei Frauen mit bereits existentem Typ-II-Diabetes
Auch bei postmenopausalen Frauen mit Diabetes scheint sich eine Hormonersatztherapie positiv auf die Blutzuckerkontrolle auszuwirken7. Die Datenlage ist allerdings nicht so umfangreich und wurde nicht über den langen Zeitraum überprüft, wie es bei Frauen ohne Diabetes der Fall ist. Die bereits oben erwähnte Metaanalyse stellte eine Reduktion des Nüchternzuckers um 11,5 % (95%-KI 18,0–5,1) und der Insulinresistenz um 35,8 % (HOMA-IR; 95%-KI 51,7–19,8) fest3.
Laut der britischen NICE Guideline stellt die transdermale HRT bei Frauen mit Typ-II-Diabetes die gängige Praxis dar40.
-
Collins, P., et al. (2007, Dec). Management of cardiovascular risk in the perimenopausal women: a consensus statement of European cardiologists and gynecologists. Climacteric, 10(6), pp. 508-26.
-
Agrinier, N., Cournot, M., & Ferrières, J. (2009, Jun). Dyslipidemia in women after 50: age, menopause or both? Ann Cardiol Angeiol (Paris), 58(3), pp. 159-64.
-
Salpeter, S., et al. (2006, Sep). Meta-analysis: effect of hormone-replacement therapy on components of the metabolic syndrome in postmenopausal women. Diabetes Obes Metab, 8(5), pp. 538-54.
-
Godsland, I. (2001, May). Effects of postmenopausal hormone replacement therapy on lipid, lipoprotein, and apolipoprotein (a) concentrations: analysis of studies published from 1974-2000. Fertil Steril, 75(5), pp. 898-915.
-
Rosenzweig, J., et al. (2008, Oct). Primary prevention of cardiovascular disease and type 2 diabetes in patients at metabolic risk: an endocrine society clinical practice guideline. J Clin Endocrinol Metab, 93(10), pp. 3671-89.
-
Rydén, L., et al. (2014, Jul). ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the ESC and developed in collaboration with the EASD. Eur Heart J, 35(27), p. 1824.
-
Mauvais-Jarvis, F., Manson, J., Stevenson, J., & Fonseca, V. (2017, Jun). Menopausal Hormone Therapy and Type 2 Diabetes Prevention: Evidence, Mechanisms, and Clinical Implications. Endocr Rev, 38(3), pp. 173-88.
-
Stuenkel, C. (2017, Feb). Menopause, hormone therapy and diabetes. Climacteric, 20(1), pp. 11-21.
-
NAMS (The North American Menopause Society). (2017, Jun). The 2017 hormone therapy position statement of The North American Menopause Society. Menopause: The Journal of The North American Menopause Society, 24(7), pp. 728-53.
-
Mechanick, J., et al. (2017, Aug). American Association of Clinical Endocrinologists and American College of Endocrinology Protocol for Standardized Production of Clinical Practice Guidelines, Algorithms, and Checklists - 2017 Update. Endocr Pract, 23(8), pp. 1006-21.
-
de Lauzon-Guillain, B., et al. (2009, Oct). Menopausal hormone therapy and new-onset diabetes in the French Etude Epidemiologique de Femmes de la Mutuelle Générale de l'Education Nationale (E3N) cohort. Diabetologia, 52(10), pp. 2092-100.
-
Kanaya, A., et al. (2003, Jan). Glycemic effects of postmenopausal hormone therapy: the Heart and Estrogen/progestin Replacement Study. A randomized, double-blind, placebo-controlled trial. Ann Intern Med, 138(1), pp. 1-9.
-
Hodis, H., et al. (2001, Dec). Estrogen in the prevention of atherosclerosis. A randomized, double-blind, placebo-controlled trial. Ann Intern Med, 135(11), pp. 939-53.
-
Harman, S., et al. (2014, Aug). Arterial imaging outcomes and cardiovascular risk factors in recently menopausal women: a randomized trial. Ann Intern Med, 161(4), pp. 249-60.
-
Lobo, R., Bush, T., Carr, B., & Pickar, J. (2001, Jul). Effects of lower doses of conjugated equine estrogens and medroxyprogesterone acetate on plasma lipids and lipoproteins, coagulation factors, and carbohydrate metabolism. Fertil Steril, 76(1), pp. 13-24.
-
Manson, J., et al. (1992, Sep). A prospective study of postmenopausal estrogen therapy and subsequent incidence of non-insulin-dependent diabetes mellitus. Ann Epidemiol, 2(5), pp. 665-73.
-
Pentti, K., et al. (2009, Jun). Hormone therapy protects from diabetes: the Kuopio osteoporosis risk factor and prevention study. Eur J Endocrinol, 160(6), pp. 979-83.
-
Espeland, M., et al. (1998, Oct). Effect of postmenopausal hormone therapy on glucose and insulin concentrations. PEPI Investigators. Postmenopausal Estrogen/Progestin Interventions. Diabetes Care, 21(10), pp. 1589-95.
-
Kim, C. (2012, Mar). Does menopause increase diabetes risk? Strategies for diabetes prevention in midlife women. Womens Health (Lond), 8(2), pp. 155-67.
-
Manson, J., et al. (2013, Oct). Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women's Health Initiative randomized trials. JAMA, 310(13), pp. 1353-68.
-
Margolis, K., et al. (2004, Jul). Effect of oestrogen plus progestin on the incidence of diabetes in postmenopausal women: results from the Women's Health Initiative Hormone Trial. Diabetologia, 47(7), pp. 1175-87.
-
Bonds, D., et al. (2006, Mar). The effect of conjugated equine oestrogen on diabetes incidence: the Women's Health Initiative randomised trial. Diabetologia, 49(3), pp. 459-68.
-
Xu, Y., et al. (2014, Jul). Combined estrogen replacement therapy on metabolic control in postmenopausal women with diabetes mellitus. Kaohsiung J Med Sci, 30(7), pp. 350-61.
-
Andersson, B., et al. (1997, Feb). Estrogen replacement therapy decreases hyperandrogenicity and improves glucose homeostasis and plasma lipids in postmenopausal women with noninsulin-dependent diabetes mellitus. J Clin Endocrinol Metab, 82(2), pp. 638-43.
-
Brussaard, H., et al. (1997, Jul). Short-term oestrogen replacement therapy improves insulin resistance, lipids and fibrinolysis in postmenopausal women with NIDDM. Diabetologia, 40(7), pp. 843-9.
-
Friday, K., Dong, C., & Fontenot, R. (2001, Jan). Conjugated equine estrogen improves glycemic control and blood lipoproteins in postmenopausal women with type 2 diabetes. J Clin Endocrinol Metab, 86(1), pp. 48-52.
-
Hulley, S., et al. (1998, Aug). Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. JAMA, 280(7), pp. 605-13.
-
Manson, J., et al. (2003, Aug). Estrogen plus progestin and the risk of coronary heart disease. N Engl J Med, 349(6), pp. 523-34.
-
Hsia, J., et al. (2006, Feb). Conjugated equine estrogens and coronary heart disease: the Women's Health Initiative. Arch Intern Med, 166(3), pp. 357-65.
-
Hodis, H., et al. (2016, Mar). Vascular Effects of Early versus Late Postmenopausal Treatment with Estradiol. N Engl J Med, 374(13), pp. 1221-31.
-
Thunell, L., Andersson, B., Glassell, M., & Mattsson, L. (2006, Mar). The effect of continuous combined HRT on glucose homeostasis and plasma lipids. A placebo-controlled study in postmenopausal women with type 2 diabetes. Maturitas, 53(4), pp. 430-8.
-
Shifren, J., et al. (2007, Nov-Dec). A randomized, open-label, crossover study comparing the effects of oral versus transdermal estrogen therapy on serum androgens, thyroid hormones, and adrenal hormones in naturally menopausal women. Menopause, 14(6), pp. 985-94.
-
Ding, E., Song, Y., Malik, V., & Liu, S. (2006, Mar). Sex differences of endogenous sex hormones and risk of type 2 diabetes: a systematic review and meta-analysis. JAMA, 295(11), pp. 1288-99.
-
Lindheim, SR, et al., (1994, Dec). The route of administration influences the effect of estrogen on insulin sensitivity in postmenopausal women. Fertil Steril. Vol. 62, 6, pp. 1176-80. Gynäkologie, Menopause.
-
Kimmerle, R, et al., (1999). Influence of continuous combined estradiol-norethisterone acetate preparations on insulin sensitivity in postmenopausal nondiabetic women. Menopause. Vol. 6, 1, pp. 36-42. Gynäkologie, Menopause.
-
Spencer, CP, et al., (2000, Jun). Effects of oral and transdermal 17beta-estradiol with cyclical oral norethindrone acetate on insulin sensitivity, secretion, and elimination in postmenopausal women. Metabolism. Vol. 49, 6, pp. 742-7. Gynäkologie, Menopause.
-
Li, C, et al., (2003, Mar). Low-dose hormone therapy and carbohydrate metabolism. Fertil Steril. Vol. 79, 3, pp. 550-5. Gynäkologie, Menopause.
-
Prior, J., et al. (2014, Jan). Progesterone therapy, endothelial function and cardiovascular risk factors: a 3-month randomized, placebo-controlled trial in healthy early postmenopausal women. PLoS One, 9(1), p. e84698.
-
Casanova, G and Spritzer, PM. (2012, Oct). Effects of micronized progesterone added to non-oral estradiol on lipids and cardiovascular risk factors in early postmenopause: a clinical trial. Lipids Health Dis. Vol. 9, 11, p. 133. Gynäkologie, Menopause.
-
National Collaborating Centre for Women's and Children's Health (UK). (2015, Nov). Menopause: Full Guideline. National Institute for Health and Care Excellence: Clinical Guidelines. Gynäkologie, Menopause.
-
The Writing Group of the PEPI Trial. (1995, Jan). Effects of estrogen or estrogen/progestin regimens on heart disease risk factors in postmenopausal women. The Postmenopausal Estrogen/Progestin Interventions (PEPI) Trial. The Writing Group for the PEPI Trial. JAMA, 273(3), pp. 199-208.
-
Wakatsuki, A., et al. (2001, May). Lipolytic enzyme effect on small low-density lipoprotein particles in women treated with estrogen. Obstet Gynecol, 97(3), pp. 333-7.
-
Mackey, R., et al. (2005, Mar). Hormone therapy, lipoprotein subclasses, and coronary calcification: the Healthy Women Study. Arch Intern Med, 165(5), pp. 510-5.
-
De Lignieres, B., et al. (1986, Mar). Biological effects of estradiol-17 beta in postmenopausal women: oral versus percutaneous administration. J Clin Endocrinol Metab, 62(3), pp. 536-41.
-
Moorjani, S., et al. (1991, Aug). Changes in plasma lipoprotein and apolipoprotein composition in relation to oral versus percutaneous administration of estrogen alone or in cyclic association with utrogestan in menopausal women. J Clin Endocrinol Metab, 73(2), pp. 373-9.
-
Jensen, J., et al. (1987, Jan). Long-term effects of percutaneous estrogens and oral progesterone on serum lipoproteins in postmenopausal women. Am J Obstet Gynecol, 156(1), pp. 66-71.
-
Pu, D, et al., (2017, Dec). Metabolic syndrome in menopause and associated factors: a meta-analysis. Climacteric. Vol. 20, 6, pp. 583-91. Gynäkologie, Menopause.
-
Nii, S, et al., (2016, Jul). Hepatic Effects of Estrogen on Plasma Distribution of Small Dense Low-Density Lipoprotein and Free Radical Production in Postmenopausal Women. J Atheroscler Thromb. Vol. 23, 7, pp. 810-8. Gynäkologie, Menopause.
-
Christodoulakos, GE, et al., (2006, Apr). Differential effect of hormone therapy and tibolone on lipids, lipoproteins, and the atherogenic index of plasma. J Cardiovasc Pharmacol. Vol. 47, 4, pp. 542-8. Gynäkologie, Menopause.
-
Cortellaro, M, et al., (1991). Cyclic hormonal replacement therapy after the menopause: transdermal versus oral treatment. Eur J Clin Pharmacol. Vol. 41, 6, pp. 555-9. Gynäkologie, Menopause.
-
de Kraker, AT, et al., (2004, Nov). The effects of 17 beta-oestradiol plus dydrogesterone compared with conjugated equine oestrogens plus medroxyprogesterone acetate on lipids, apolipoproteins and lipoprotein(a). Maturitas. Vol. 49, 3, pp. 253-63. Gynäkologie, Menopause.
-
Ichikawa, J, et al., (2006, Jul). Different effects of transdermal and oral hormone replacement therapy on the renin-angiotensin system, plasma bradykinin level, and blood pressure of normotensive postmenopausal women. Am J Hypertens. Vol. 19, 7, pp. 744-9. Gynäkologie, Menopause.
-
Rabbani, LE, et al., (2002, Dec). Oral conjugated equine estrogen increases plasma von Willebrand factor in postmenopausal women. J Am Coll Cardiol. Vol. 40, 11, pp. 1991-9. Gynäkologie, Menopause.
-
Sendag, F, et al., (2002, Jan). Effects of sequential combined transdermal and oral hormone replacement therapies on serum lipid and lipoproteins in postmenopausal women. Arch Gynecol Obstet. Vol. 266, 1, pp. 38-43. Gynäkologie, Menopause.
-
Sumino, H, et al., (2006, Dec). Different effects of oral conjugated estrogen and transdermal estradiol on arterial stiffness and vascular inflammatory markers in postmenopausal women. Atherosclerosis. Vol. 189, 2, pp. 436-42. Gynäkologie, Menopause.
-
Fahraeus, L., Larsson-Cohn, U., & Wallentin, L. (1983). L-norgestrel and progesterone have different influences on plasma lipoproteins. Eur J Clin Invest, 13, pp. 447-53.
-
Miller, VT, et al., (1991, Feb). Effects of conjugated equine estrogen with and without three different progestogens on lipoproteins, high-density lipoprotein subfractions, and apolipoprotein A-I. Obstet Gynecol. Vol. 77, 2, pp. 235-40. Gynäkologie, Menopause.
-
Sherwin, BB and Gelfand, MM. (1989, May). A prospective one-year study of estrogen and progestin in postmenopausal women: effects on clinical symptoms and lipoprotein lipids. Obstet Gynecol. Vol. 73, 5 Pt 1, pp. 759-66. Gynäkologie, Menopause.
-
Colvin, PL Jr, et al., (1991, Oct). A dose-response relationship between sex hormone-induced change in hepatic triglyceride lipase and high-density lipoprotein cholesterol in postmenopausal women. Metabolism. Vol. 40, 10, pp. 1052-6. Gynäkologie, Menopause.
-
Bush, TL, et al., (1987, Jun). Cardiovascular mortality and noncontraceptive use of estrogen in women: results from the Lipid Research Clinics Program Follow-up Study. Circulation. Vol. 75, 6, pp. 1102-9. Gynäkologie.
-
Barrett-Connor, E, et al., (1997, Jul). The Postmenopausal Estrogen/Progestin Interventions Study: primary outcomes in adherent women. Maturitas. Vol. 27, 3, pp. 261-74. Gynäkologie, Menopause.
-
Tikkanen, MJ. (1996, Mar). The menopause and hormone replacement therapy: lipids, lipoproteins, coagulation and fibrinolytic factors. Maturitas. Vol. 23, 2, pp. 209-16. Gynäkologie, Menopause.
-
Saarikoski, S., Yliskoski, M., Penttilä, I. (1990). Sequential use of norethisterone and natural progesterone in pre-menopausal bleeding disorders. Maturitas, 12(2), 89-97.
-
Ottosson, U., Johansson, B., & von Schoultz, B. (1985). Subfractions of high-density lipoprotein cholesterol during oestrogen replacement therapy: a comparison between progestogens and natural progesterone. Am J Obstet Gynecol, 151, pp. 746-50.