HRT und kardiovaskuläre Erkrankungen
In den postmenopausalen Jahren steigt die Prävalenz für kardiovaskuläre Erkrankungen wie Herzinfarkt und Schlaganfall stark an. Peri- und früh postmenopausale Frauen ohne relevante kardiovaskuläre Risikofaktoren haben ein sehr geringes Risiko für Herz-Kreislauf-Krankheiten und eine hohe Lebenserwartung, allerdings bilden sie eine Minderheit.
Prävention kardiovaskulärer Erkrankungen
Bei Frauen in der Postmenopause steigt die Zahl der Todesfälle durch kardiovaskuläre Erkrankungen stark an. 2015 verstarben in Deutschland 670 der 45 bis unter 50 Jahre alten Frauen an Krankheiten des Kreislaufsystems, bei den 55 bis unter 60 Jahre alten Frauen waren es bereits 1.833 und bei den 65 bis unter 70 Jahre alten Frauen 4.3941. Daher sollte an erster Stelle ihre Prävention durch Vermeidung wesentlicher Risikofaktoren wie Rauchen und Übergewicht stehen, zusätzlich bieten eine gesunde Ernährung (reich an Obst, Gemüse und Fisch sowie arm an gesättigten Fettsäuren) und ein hohes Maß an körperlicher Aktivität Schutz vor Herz-Kreislauf-Krankheiten2.
HRT und die Progression von Arteriosklerose
In experimentellen Studien ist gezeigt worden, dass Estrogene zahlreiche biochemische Veränderungen in Gefäßen hervorrufen, die eine Initiierung und Progression einer Arteriosklerose verlangsamen können (Tab. 1). Bei bereits etablierten arteriosklerotischen Plaques könnten sie allerdings eine Thrombogenese und damit deren Ruptur fördern3. Entsprechend gibt es die Theorie des „Windows of Opportunity“, welche besagt, dass eine zum Zeitpunkt der Menopause einsetzende Hormonbehandlung langfristig antiarteriosklerotisch wirkt4, während ein Beginn bei Frauen mit bereits fortgeschrittener Arteriosklerose keine positiven Wirkungen mehr entfalten kann und früh im Behandlungsverlauf aufgrund entzündlicher und prothrombotischer Effekte eher nachteilig wirkt3,5. Basis hierfür sind neben den Auswertungen klinischer Endpunkte auch Studien, in denen die Dicke von Intima und Media der A. carotis communis (carotid artery intima media thickness = CIMT) als Surrogatmarker analysiert wurden.
Tabelle 1: Mögliche kardioprotektive Effekte von Estrogen* (modifiziert nach Mikkola et al. 20176)
| Direkte Effekte | Indirekte Effekte |
|---|---|
| Endotheliales Zellwachstum ↑ | Gesamt-Cholesterin ↓, LDL ↓, HDL ↑ |
| Zellwachstum glatte Muskulatur ↓ | Antioxidative Effekte: Oxidation von LDL ↓ |
| Progression arteriosklerotischer Plaques ↓ | Blutdruck ↓ |
| Stickstoffproduktion und -Freisetzung ↑ | Kardiomyozyten: Ischämie/Reperfusionsschäden ↓ kardiale Hypertrophie ↓ |
| Prostacyclin-Produktion und -Freisetzung ↑ | Insulinsensitivität ↑ |
| Endothelin-1 ↓ | Homocystein ↓ |
| Zytokin-Freisetzung ↓ | |
| Entzündungsreaktion ↓ |
* Die Daten stammen aus verschiedenen Reviews: Mendelsohn et al. 19997, Dimitrova et al. 20028, Mendelsohn et al. 20053, Menazza et al. 20169.
Eine zunehmende Dicke von Intima und Media der großen Arterien wird als frühes Zeichen einer beginnenden generalisierten Arteriosklerose angesehen und wurde auch mit einer Risikozunahme für die koronare Herzkrankheit in Zusammenhang gebracht10,11,12.
In einer klinischen Studie13 wurden 159 kardiovaskulär gesunde postmenopausale Frauen im Alter zwischen 45 und 65 Jahren, die zusätzlich keine kardiovaskulären Risikofaktoren aufwiesen, abhängig vom Alter (< oder > 55 Jahre) und einer möglichen Hormonsubstitution in vier Gruppen eingeteilt. Frauen, die eine HRT durchführten, substituierten transdermal (mit einem Estradiol-Gel bzw. -Pflaster) und die Therapie war frühzeitig im Jahr der Menopause begonnen worden. Wurde ein Gestagen eingenommen, so handelte es sich um eine antiandrogene Verbindung. Während sich bei jüngeren Frauen (< 55 Jahre) die Intima-Media-Dicke der Karotis unabhängig von einer HRT nicht signifikant unterschied, zeigten ältere Frauen (> 55 Jahre) mit frühzeitig begonnener HRT gegenüber gleichaltrigen Frauen ohne HRT im Mittel signifikant geringere CIMT. Besonders deutlich waren die Unterschiede bei Frauen, die eine Hormonsubstitution bereits über 7 oder mehr Jahre durchführten. Die Intima-Media-Dicke zeigte bei unbehandelten Frauen auch eine deutliche altersabhängige Zunahme, während dies für Frauen unter HRT nicht der Fall war.
Im Rahmen der KEEPS-Studie (Kronos Early Estrogen Prevention Study), einer randomisierten, doppelblinden, Placebo-kontrollierten Studie, wurde die Anwendung von transdermalem Estradiol mit der Anwendung von oralen konjugierten Stutenestrogenen verglichen14. Als Gestagen kam das stoffwechselneutrale Progesteron zum Einsatz. Es sollte das Fortschreiten von Arteriosklerose und anderer Risikofaktoren für kardiovaskuläre Erkrankungen unter einer kurz nach der Menopause begonnenen HRT untersucht werden. Dabei zeigten sich keine Unterschiede in der subklinischen Progression arteriosklerotischer Plaques zwischen Placebo und dem Behandlungsarm. Die Progression war allerdings bei dem insgesamt sehr gesunden Studienkollektiv über den Studienzeitraum ausgesprochen gering. Kardiovaskuläre Risikofaktoren zeigten sich nach 4 Jahren im Vergleich zu Placebo entweder nicht verändert (z. B. Bluthochdruck) oder wurden durch eine Hormontherapie positiv beeinflusst (HOMA-IR).
In der ELITE-Studie (Early versus Late Intervention Trial with Estradiol)15, einer randomisierten Placebo-kontrollierten Studie, wurden im Gegensatz zur KEEPS-Studie nicht nur früh postmenopausale (< 6 Jahre seit Eintritt der Menopause), sondern auch spät postmenopausale Frauen (≥ 10 Jahre seit Eintritt der Menopause) eingeschlossen. Insgesamt erhielten 643 Probandinnen Estradiol bzw. Placebo und Frauen mit intaktem Uterus verwendeten zusätzlich noch Progesteron als Vaginalgel. Die Zunahme der Intima-Media-Dicke der Karotis stellte sich in diesen beiden Gruppen unterschiedlich dar. So war die Dickenzunahme in der Estradiol-Gruppe bei den Frauen in der frühen Postmenopause im Vergleich zur Placebo-Gruppe signifikant verringert. Bei Frauen, die sich in der späten Postmenopause befanden, war dieser Unterschied nicht zu beobachten.
Als ein weiterer Hinweis auf die antiarteriosklerotische Wirkung von Estrogenen kann die Beobachtung gesehen werden, dass bei frühzeitigem Estrogenentzug wie es bei Frauen mit POF (premature ovarian failure) oder früher Menopause auftritt, höhere Raten an kardiovaskulären Ereignissen zu beobachten sind16.
Orale versus transdermale Anwendung
Es gibt derzeit keine Daten, die auf einen Unterschied zwischen der oralen und der transdermalen Anwendung von Estrogenen auf den Beginn und die Progression arteriosklerotischer Plaques schließen lassen. In der oben erwähnten KEEPS-Studie fanden sich weder zwischen oralen konjugierten equinen Estrogenen (CEE) und transdermalem Estradiol Unterschiede hinsichtlich der Arteriosklerose-Progression, noch im Vergleich mit Placebo.
Risiko für koronare Herzerkrankungen
Die kombinierte Estrogen-Gestagen-Behandlung deutete in der HERS-Studie (Heart and Estrogen/progestin Replacement Study)17 bei Frauen mit vorbestehenden Herzerkrankungen im mittleren Alter von 67 Jahren sowie in der WHI-Studie18 bei Frauen, die im Wesentlichen ohne bekannte Herzkrankheit und im mittleren Alter von 63 Jahren waren, auf ein erhöhtes Risiko von Koronarereignissen (v. a. Herzinfarkten) im ersten Jahr der Anwendung hin. Eine mögliche Schadwirkung von Hormonen auf die Gefäße im frühen Behandlungsverlauf wurde auf eine Destabilisierung arteriosklerotischer Plaques bei Frauen mit vorbestehenden Gefäßschädigungen bezogen3,5. In der darauffolgenden Subgruppenanalyse der WHI-Ergebnisse im Jahr 200719 wurde für jüngere Frauen (Alter 50–59 Jahre bei Studienbeginn) insgesamt kein erhöhtes Koronar-Risiko (HR 0,93; 95%-KI 0,65–1,33) festgestellt. 13 Jahre nach der Interventionsphase zeigte sich sogar ein protektiver Effekt auf koronare Herzerkrankungen bei den jüngeren Frauen, die Estrogene alleine einnahmen (HR 0,65; 95%-KI 0,44–0,96)20. Im Kombinationsarm hingegen, in dem als Gestagen MPA (= Medroxyprogesteronacetat) eingesetzt wurde, war das Risiko nicht signifikant erhöht (HR 1,27; 95%-KI 0,93–1,74).
Aus der US-amerikanischen Nurses Health Study wurde 2006 berichtet, dass Frauen, die eine Hormontherapie innerhalb von 4 Jahren nach Eintritt der Menopause begonnen hatten, ein um 34 % signifikant vermindertes Koronarrisiko bei alleiniger Estrogenanwendung aufwiesen; bei kombinierter Estrogen-Gestagen-Anwendung war die signifikante Risikoreduktion ähnlich (–28 %)21.
Orale versus transdermale Anwendung
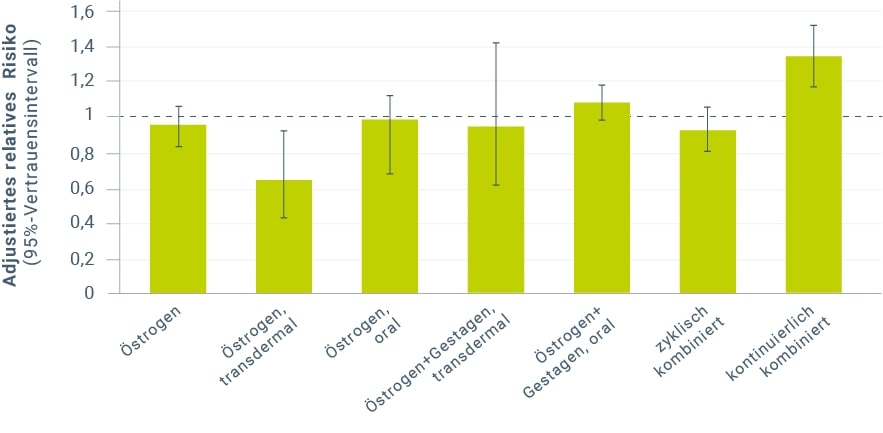
In einer dänischen Register-Studie (Danish Sex Hormone Register Study = DaHoRS)22 wurden unter anderem die transdermale und orale Applikation von Estrogenen hinsichtlich des Myokardinfarkt-Risikos untersucht. In einem Zeitraum vom 01.01.1995 bis 31.12.2001 wurden bei fast 700.000 Frauen im Alter zwischen 51 und 70 Jahren in fast 3 Millionen Beobachtungsjahren annähernd 5.000 Herzinfarkte erfasst, was einer absoluten Herzinfarkthäufigkeit von 0,17 % pro Jahr entsprach. Insgesamt war die derzeitige Anwendung einer Hormontherapie nicht mit einem erhöhten Herzinfarkt-Risiko assoziiert (relatives Risiko [RR] 1,03; 95%-KI 0,96–1,11). Die frühere Anwendung von Hormonen war mit einer Reduktion des Herzinfarkt-Risikos verbunden (RR 0,81; 95%-KI 0,71–0,93). Hinsichtlich unterschiedlicher Formen wurde ein erhöhtes Risiko mit kontinuierlich-kombinierter Hormontherapie (adjustiertes RR 1,35; 95%-KI 1,18–1,53), nicht jedoch mit Tibolon, mit alleiniger Estrogen- oder mit zyklischer Estrogen-Gestagen-Anwendung gefunden. Während bei kombinierter Estrogen-Gestagen-Therapie kein signifikanter Unterschied zwischen oraler und transdermaler Anwendung auffiel, wurde für die alleinige transdermale Anwendung von Estradiol als Gel oder Pflaster ein signifikant vermindertes Herzinfarktrisiko (adjustiertes RR 0,62; 95%-KI 0,42–0,93, Abb. 1) bestimmt, wobei allerdings der Beobachtungsumfang (31.354 Frauenjahre) und die Zahl der registrierten Herzinfarkt-Fälle23 in dieser Kategorie gering war. Das Risiko war auch signifikant vermindert im Vergleich zur alleinigen oralen Estrogenanwendung.
In einer Metaanalyse von vier Beobachtungsstudien22,24,25,26 konnte ein Vorteil mit der transdermalen Anwendung allerdings nicht bestätigt werden (oral versus transdermal RR 1,17; 95%-KI 0,80–1,72)27.
Abbildung 1: Herzinfarkt-Risiko bei derzeitiger Anwendung einer Hormontherapie, Auswertung nach Applikationsroute und Regime, DaHoRS (Angaben nach Løkkegaard et al. 2008)22.
Schlaganfallrisiko
In der WHI-Studie28 zeigte der Estrogenarm, wie bereits der Kombinationsarm29 ein gegenüber Placebo signifikant erhöhtes Schlaganfallrisiko. Eine Re-Analyse19 der Daten beider Hormonarme der WHI fand bei Frauen, die zu Studienbeginn 50–59 Jahre alt waren keine signifikante Erhöhung (Hazard-Ratio [HR] 1,13; 95%-Konfidenzintervall [95%-KI] 0,73–1,76), während für bei Beginn 60–69 Jahre alte Frauen eine signifikante Erhöhung bestand (HR 1,50; 95%-KI 1,17–1,92).
Eine weitere randomisierte, allerdings offene Studie, in der das Schlaganfallrisiko ausgewertet wurde, ist die DOPS-Studie (Danish Osteoporosis Prevention Study). In der DOPS-Studie wurden 1.006 gesunde, früh postmenopausale Frauen, im Alter von 49,7 ± 2,8 Jahren hinsichtlich einer HRT als Osteoporoseprävention untersucht, mit einem Follow-up nach 10,1 Jahren. Es zeigten sich keine Unterschiede in den Schlaganfall-Raten zwischen der Kontroll- und der Behandlungsgruppe (14 Fälle in der Kontroll- versus 11 Fälle in der Behandlungsgruppe (HR 0,77; 95%-KI 0,35–1,70; P = 0,70)30.
Eine Metaanalyse dieser randomisierten kontrollierten Studien fand kein erhöhtes Risiko bei Frauen, die jünger als 60 Jahre waren und/oder bei denen die Menopause weniger als 10 Jahre zurücklag31.
Die meisten Beobachtungsstudien mit postmenopausalen Frauen zeigten im Wesentlichen keinen Anstieg des Schlaganfallrisikos, wenn die Hormontherapie bald nach Eintritt der Menopause begonnen wurde32,33,34,35,36,37. Eine Ausnahme stellt die groß angelegte Nurses‘ Health Study dar. Hier konnte bei den Anwenderinnen einer HRT mit CEE ein höheres Risiko für ischämischen Schlaganfall als bei den Nicht-Anwenderinnen beobachtet werden38.
Dosisabhängigkeit und Einfluss der Applikationsroute auf das Apoplexrisiko
In der Nurses‘ Health Study wurde ein Zusammenhang zwischen der Estrogen-Dosis (verwendet wurden CEE) und dem Schlaganfallrisiko beobachtet. Bei einer Einnahme von 0,3 mg Estrogen pro Tag war die Schlaganfallrate vergleichbar mit der Rate bei Frauen, die nie eine Hormontherapie angewendet hatten (adjustiertes RR 0,93; 95%-KI 0,62–1,40). Eine signifikante Zunahme der Schlaganfallrate fand sich jedoch bei Dosen von 0,625 mg CEE (RR 1,54; 95%-KI 1,31–1,81) und 1,25 mg (RR 1,62; 95%-KI 1,23–2,14)38. In drei nicht interventionellen Studien wurde das Schlaganfallrisiko unter oraler und transdermaler Anwendung, sowie die Dosisabhängigkeit untersucht:
Eine in UK durchgeführte nested Fall-Kontrollstudie zeigte je nach Applikationsweg eine unterschiedliche Dosisabhängigkeit für das Auftreten von Schlaganfällen. Bei Anwendung einer transdermalen HRT war das Schlaganfallrisiko bei niedrig dosiertem Estrogen nicht erhöht im Vergleich zu Nicht-HRT-Anwenderinnen (RR 0,81; 95%-KI 0,62–1,05), bei höher dosiertem transdermalem Estrogen trat allerdings eine Erhöhung des Schlaganfallrisikos auf (RR 1,89; 95%-KI 1,15–3,11). Bei Anwenderinnen einer oralen HRT konnte sowohl bei niedrigen als auch bei hohen Dosen ein erhöhtes Risiko für Schlaganfälle beobachtet werden (RR 1,28; 95%-KI 1,15–1,42)39. Eine französische Datenbankanalyse mit Frauen im Alter von 51–62 Jahren untersuchte den Einfluss der Estrogenapplikationsform und des Gestagentyps bei Anwendung einer Hormontherapie auf das Schlaganfallrisiko40. Es wurde auf die Daten aller Frauen in dieser Altersklasse zwischen dem 1. Januar 2009 und 31. Dezember 2011 zugegriffen und eine entsprechende Selektion der Falldaten vorgenommen. Die Auswertung ergab, dass das Risiko für ischämische Schlaganfälle bei Verwendung eines transdermalen Estrogens im Vergleich zu Frauen, die keine HRT anwendeten, nicht erhöht war (adjustierte Odds Ratio [OR] 0,83; 95%-KI 0,56–1,24). Bei oralen Estrogenen hingegen fand sich ein signifikanter Anstieg des Schlaganfallrisikos, der von der verwendeten Dosis beeinflusst wurde (adjustierte OR 1,58; 95%-KI 1,01–2,49). Bei der transdermalen Anwendung konnte keine Dosisabhängigkeit beobachtet werden.
In einer aktuellen dänischen Kohortenstudie untersuchten Løkkegaard et al. das Schlaganfallrisiko bei verschiedenen Anwendungsformen der menopausalen Hormontherapie41. Sie beobachteten ein erhöhtes Risiko für ischämischen Schlaganfall bei Anwendung einer oralen HRT. Bei transdermaler Applikation wurde kein Einfluss auf das Schlaganfallrisiko festgestellt. Die Dosisabhängigkeit wurde in dieser Studie nur allgemein untersucht, nicht im Hinblick auf eine transdermale oder orale Anwendung. Bei niedriger Dosierung wurde hierbei kein erhöhtes Risiko für Schlaganfall festgestellt, nur bei mittlerer bis hoher Dosis. Das höchste Risiko wurde bei Anwendung einer kontinuierlichen Kombinationstherapie beobachtet, im Vergleich zu einer zyklischen Kombinationstherapie oder einer Monotherapie.
Wahl des Gestagens
Verschiedene klinische Studien legen den Schluss nahe, dass es auf das Schlaganfallrisiko keinen Einfluss hat, ob eine Estrogen-Monotherapie (oral) oder eine kombinierte Estrogen-Gestagen-Therapie angewandt wird28,29,36. In einer nested Fallkontrollstudie von Renoux et al.39 wurden das Schlaganfallrisiko betreffend keine Unterschiede zwischen Anwendern einer oralen Mono- (OR 1,35; 95%-KI 1,16–1,58) oder Kombinationstherapie (OR 1,24; 95%-KI 1,08–1,41) beobachtet. Bei einer transdermalen Hormontherapie zeigte sich das Schlaganfallrisiko sowohl bei der Mono- (RR 1,02; 95%-KI 0,78–1,34) als auch bei der Kombinationstherapie (RR 0,76; 95%-KI 0,47–1,22) nicht erhöht.
Neuere Studien weisen allerdings darauf hin, dass die Art des verwendeten Gestagens bei einer Kombinationstherapie einen Einfluss auf das Schlaganfallrisiko hat. Bei einer französischen nested Fall-Kontroll-Studie wurde keine Assoziation mit ischämischem Schlaganfall bei Progesteron (OR 0,78; 95%-KI 0,49–1,26), Pregnan-Derivaten (OR 1,00; 95%-KI 0,60–1,67) und Nortestosteron-Derivaten (OR 1,26; 95%-KI 0,62–2,58) beobachtet, Norpregnan-Derivate zeigten dagegen einen Anstieg des Schlaganfallrisikos (OR 2,25; 95%-KI 1,05–4,81)40.
In einer aktuellen dänischen Kohortenstudie untersuchten Løkkegaard et al. das Schlaganfallrisiko bei verschiedenen Anwendungsformen der menopausalen Hormontherapie41. Bei den Gestagenen beobachteten sie ein erhöhtes Risiko für ischämischen Schlaganfall nur bei Verwendung von Norethisteron (NETA) (sowohl im Rahmen einer HRT oder als kombiniertes orales Kontrazeptivum), nicht bei MPA oder Levonorgestrel (LNG). Die Tibolon-Anwendung war ebenfalls mit einem Risikoanstieg assoziiert.
"Windows of Opportunity“- und „Timing“-Hypothese
Der komplexe Zusammenhang von Hormoneffekten auf den Arteriosklerose-Prozess einerseits und auf kardiovaskuläre Ereignisse andererseits, wie er insbesondere im Kombinationsarm der WHI-Studie18 und in HERS17 beobachtet wurde, wird mit der „Window of Opportunity“-Hypothese erklärt, die besagt, dass eine zum Zeitpunkt der Menopause einsetzende Hormonbehandlung langfristig antiarteriosklerotisch wirkt4, während ein Beginn bei Frauen mit bereits fortgeschrittener Arteriosklerose keine positiven Wirkungen mehr entfalten kann und früh im Behandlungsverlauf aufgrund entzündlicher und prothrombotischer Effekte eher nachteilig wirkt3,5. Die „Windows of Opportunity“-Hypothese bzw. vorteilhafte kardiovaskuläre Effekte einer früh begonnenen HRT wurde in zwei aktuellen Studien untersucht: in der KEEPS- und ELITE-Studie.
In anderen Studien wird die Hypothese des Zeitfensters aufgeweicht und von einer „Timing-Hypothese“ gesprochen. Danach profitieren zwar insbesondere jüngere Frauen von der HRT, aber es sind auch in höherem Alter positive Auswirkungen der Hormonbehandlung zu erkennen42. Bei einem frühzeitigen Beginn der HRT ist der kardiovaskuläre Nutzen umso höher, je eher die Therapie begonnen wird6.
Risiko für venöse Thromboembolien (VTE)
Eine orale Anwendung von Estrogenen führt nicht zuletzt aufgrund der ersten Leberpassage (Induktion der Proteinsynthese) zu einer Aktivierung des Gerinnungssystems und erhöht somit das Risiko für venöse Thrombosen bzw. Thromboembolien, wie dies übereinstimmend in epidemiologischen und randomisierten klinischen Studien gezeigt werden konnte43,44,45,46,47,48,49,50,51,52,53. Dabei scheint das Risiko im ersten Jahr der Anwendung am höchsten zu sein.
Venöse Thromboembolien umfassen die tiefe Beinvenenthrombose sowie Lungenembolien. Bei beiden wird das Risiko durch eine orale Hormontherapie in allen Altersstufen erhöht31, obwohl in der WHI-Studie ein geringes absolutes Risiko bei Frauen unter 60 Jahre beobachtet wurde. Das Risiko steigt mit dem Auftreten von Risikofaktoren und scheint im Laufe des Anwendungszeitraums wieder zu sinken. Es wird erhöht durch eine frühere VTE-Krankengeschichte, durch Übergewicht und eine Faktor-V-Leiden-Mutation44,54,56,57. Möglicherweise ist eine orale Estrogen-Therapie in geringerer Dosierung mit einem niedrigeren VTE-Risiko verbunden als eine Behandlung mit höherer Dosierung58, es fehlen jedoch noch vergleichende Daten aus randomisiert kontrollierten Studien. Dagegen haben randomisiert kontrollierte Studien dokumentiert, dass das VTE-Risiko am Beginn einer Hormontherapie rasch ansteigt (innerhalb der ersten 1–2 Jahre) und im Laufe der Zeit wieder abnimmt46.
In der US-amerikanischen Heart and Vascular Health Study, einer von 1989 bis 2009 durchgeführten Fall-Kontroll-Studie, wurde bei der Verwendung von oralen konjugierten equinen Estrogenen (CEE) ein höheres Risiko für venöse Thrombosen beobachtet als bei der Verwendung von oralem Estradiol59. In der Million-Frauen-Studie wurde hingegen kein erhöhtes Risiko festgestellt55. Weitere Studien, die diesen Sachverhalt analysieren, stehen allerdings noch aus.
Orale versus transdermale Anwendung
Obgleich es keine randomisierten, kontrollierten Studien für die transdermale Anwendung gibt, die das Risiko für venöse Thromboembolien untersuchen, weisen verschiedene große Beobachtungsstudien darauf hin, dass transdermal verabreichtes Estradiol im Hinblick auf das Thromboserisiko sicherer ist als oral eingenommene Estrogene27,55,60,61,62,63. Dies ist plausibel, da bekanntermaßen die oralen Estrogene durch den Leber-First-Pass zu einer Induktion der Synthese von Gerinnungs- und Fibrinolysefaktoren führen, mit einer Tendenz zugunsten der Gerinnungsfaktoren; hingegen konnte bisher kein eindeutiger Effekt einer transdermalen Estrogensubstitution auf die wesentlichen Gerinnungsfaktoren oder Faktoren der Fibrinolyse aufgezeigt werden48,49,50. Veränderungen waren meist auf einzelne Faktoren beschränkt. Bei bekannter Thrombophilie ist jedoch das erhöhte Basis-Risiko für venöse Thromboembolien in der Nutzen-Risiko-Abwägung zu beachten. Speziell Frauen mit einer Disposition für venöse Thromboembolien (Übergewicht, genetisch fixierte Thrombophilie) sollten daher orale Estrogene meiden.
Auch in den zwei französischen Beobachtungsstudien ESTHER und E3N konnten wichtige Informationen zum VTE-Risiko gewonnen werden. In der großen Fall-Kontroll-Studie EStrogen and THromboEmbolism Risk (ESTHER) Study wurde das erhöhte Risiko für venöse Thrombosen und Lungenembolien mit oraler Estrogengabe bestätigt, jedoch ergab sich keine Risikoerhöhung mit transdermaler Estrogengabe als Gel oder Pflaster60. Im Februar 2007 wurden anhand eines erweiterten Kollektivs mit insgesamt 271 Thrombosefällen und 610 Kontrollen nochmals die Bedeutung des Applikationsweges der Estrogene und die Wahl des Gestagens für das Nutzen-Risiko-Profil einer Hormontherapie betont34. Orales Estradiol in einer mittleren Dosierung von 1,5 mg täglich war mit einem 4,2-fachen Risiko venöser Thromboembolien assoziiert, während transdermales Estradiol nicht zu einer Risikoerhöhung führte.
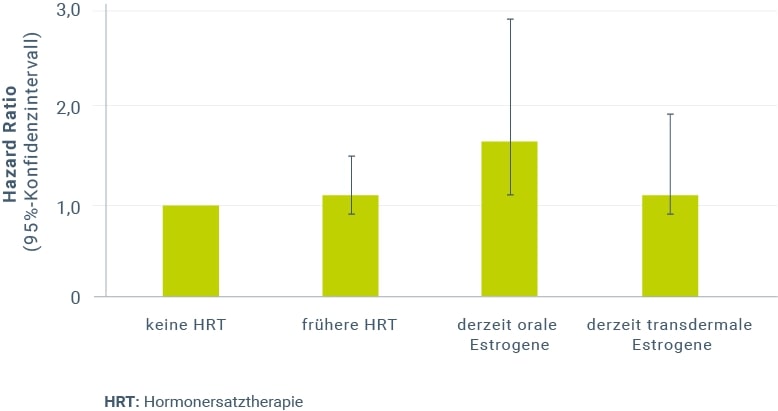
Die Ergebnisse der ESTHER-Studie wurden durch die E3N-Kohortenstudie64 qualitativ bestätigt. In der E3N-Studie wurden mehr als 80.000 postmenopausale Frauen über durchschnittlich 10 Jahre hinsichtlich des erstmaligen Auftretens idiopathischer venöser Thromboembolien beobachtet. Insgesamt wurden 549 entsprechende Thromboembolie-Fälle registriert. Wie in der ESTHER-Studie war nur die orale (HR 1,7; 95%-KI 1,1–2,8), nicht jedoch die transdermale Estrogenanwendung (HR 1,1; 95%-KI 0,8–1,8) mit einem signifikant erhöhten Thromboserisiko im Vergleich zu Nichtanwenderinnen verbunden (Abb. 2). Da hormonbedingte Thromboserisiken bei Therapiebeginn am höchsten sind, halten die Autoren transdermale Estrogene allein oder in Kombination mit mikronisiertem Progesteron wegen der diesbezüglichen Sicherheit für eine gute Erstoption der Hormontherapie.
Weitere Analysen aus der ESTHER-Studie sprechen dafür, dass eine transdermale Estradiolanwendung auch bei übergewichtigen oder adipösen Frauen und bei Frauen mit Thrombophilie das Grundrisiko für venöse Thrombosen nicht zusätzlich ungünstig beeinflusst65,66. Dagegen scheint eine aktuelle orale Estrogentherapie in Verbindung mit einem erhöhten BMI das VTE-Risiko zusätzlich zu steigern. Im Gegensatz dazu ist eine transdermale Estrogenanwendung bei Frauen mit Übergewicht nicht mit einem zusätzlichen VTE-Risiko verbunden66. Die Ergebnisse hinsichtlich des unterschiedlichen VTE-Risikos in Abhängigkeit von der Anwendungsart werden durch biologische Daten unterstützt. Eine orale Estrogen-Therapie führt im Gegensatz zur transdermalen Behandlung zu einer Aktivierung der Blutkoagulation, was an einer Erhöhung der Plasmakonzentration von Prothrombin-Fragment 1+2 beobachtet werden kann49,50.
Abbildung 2: Einfluss einer Hormontherapie auf das Risiko venöser Thromboembolien in Abhängigkeit vom Verabreichungsweg der Estrogene; multi-adjustierte HR mit 95%-KI (Angaben nach Canonico et al. 2010)64.
Wahl der Gestagene
Auch die Wahl des Gestagens in einer Estrogen-Gestagen-Kombinationstherapie scheint das VTE-Risiko zu beeinflussen. In der ESTHER-Studie wurde ein signifikant erhöhtes Risiko bei Anwenderinnen von Norpregnan-Derivaten im Vergleich zu Nichtanwenderinnen beobachtet (OR 3,9; 95%-KI 1,5–10,2). Keine signifikante Erhöhung des VTE-Risikos zeigte sich dagegen bei Verwendung von mikronisiertem Progesteron (OR 0,7; 95%-KI 0,3–2,0) oder Pregnan-Derivaten (OR 0,9; 95%-KI 0,4–2,4)34. In der E3N-Studie ergab sich wie in der ESTHER-Studie kein erhöhtes Thromboserisiko bei der Kombination von Estrogenen mit mikronisiertem Progesteron (HR 0,9; 95%-KI 0,6–1,5), während bei Kombination mit Norpregnan-Derivaten eine Risikosteigerung auffiel (HR 1,8; 95%-KI 1,2–2,7).
Auch in der britischen Million-Frauen-Studie wurden Unterschiede zwischen den Gestagen-Komponenten festgestellt55. So war das Risiko deutlich höher mit MPA als mit Norethisteron/Norgestrel im Vergleich zu Nichtanwenderinnen (RR 2,67; 95%-KI 2,25–3,17 versus RR 1,91; 95%-KI 1,69–2,17). Progesteron oder Dydrogesteron wurde nicht untersucht bzw. in der Population angewandt.
Aktuelle Empfehlungen zur Anwendung einer Hormontherapie hinsichtlich des VTE-Risikos
Das Risiko für venöse Thromboembolien wird bei gesunden Frauen, die keine Risikofaktoren aufweisen, sehr gering eingeschätzt67. Allerdings gehört zunehmendes Alter zu den Risikofaktoren, zusätzlich erhöhen kardiovaskuläre Erkrankungen, Adipositas, Frakturen, Nierenerkrankungen und Thrombophilien das Risiko für VTE. Daher sollten vor dem Verschreiben einer HRT die persönliche und die familiäre Krankengeschichte genau besprochen sowie Nutzen und Risiken abgewogen werden. Außerdem sollte die Anwendung einer transdermalen Estrogenbehandlung erwogen werden, da diese als weniger thrombogen angesehen wird67.
Laut den Empfehlungen der internationalen Menopausegesellschaft (IMS)68 ist eine orale Estrogentherapie bei Frauen mit einer VTE-Vorgeschichte kontraindiziert und die transdermale Anwendung bei übergewichtigen Frauen mit klimakterischen Beschwerden die Therapie der 1. Wahl. Das Risiko für venöse Thromboembolien steigt mit dem Alter und bei Anwendung einer oralen Hormontherapie, das absolute Risiko ist aber bei einem Alter unter 60 Jahren sehr gering. Beobachtungsstudien haben ein geringeres Risiko aufgezeigt, wenn eine niedrigdosierte transdermale Therapie in Kombination mit Progesteron verwendet wird. Diese Beobachtung scheint aus biologischer Sicht sehr plausibel68.
In dem aktuellen Positionspapier der nordamerikanischen Menopausegesellschaft (NAMS)69 wird empfohlen, bei gesunden Frauen mit Menopausebeschwerden, die jünger als 60 Jahre oder weniger als 10 Jahre vom Eintritt der Menopause entfernt sind, die positiven Effekte einer Hormontherapie auf die Gesamtmortalität gegenüber der selten auftretenden Risikoerhöhung für VTE abzuwägen. Dabei sollten persönliche und familiäre Risikofaktoren einbezogen werden.
Morbidität und Mortalität unter einer HRT hinsichtlich kardiovaskulärer Erkrankungen insgesamt
Es ist davon auszugehen, dass ein frühzeitiger Beginn der HRT einen positiven Effekt auf das Herz-Kreislauf-System hat6,30. Dafür spricht auch, dass das Risiko für Herzinfarkte oder Herztod im Estrogenarm der WHI-Studie für Frauen im Alter zwischen 50 und 59 Jahren bei Studienbeginn um 37 % reduziert und selbst für ältere Patientinnen nicht signifikant erhöht war70. Bei Einbeziehung von Fällen mit bestätigter Angina pectoris, Myokardinfarkt sowie Fällen, in denen koronare Revaskularisierungen durchgeführt wurden, ergab sich bei der Nurses Health Study für einen frühen Beginn innerhalb 4 Jahre nach der Menopause eine signifikante Risikoreduktion durch Estrogene (RR 0,62; 95%-KI 0,52–0,76) oder eine kombinierte Hormontherapie (RR 0,71; 95%-KI 0,65–0,89). Bei einer Initiierung der Therapie 10 Jahre nach der Menopause war eine Risikoreduktion nicht mehr zu beobachten (Estrogen-Monotherapie: RR 0,87; 96%-KI 0,69–1,1; Estrogen-Gestagen-Kombinationstherapie: RR 0,90; 95%-KI 0,62–1,29)21.
In einem Cochrane-Review von 201531 wurde beschrieben, dass Frauen, die die HRT weniger als 10 Jahre nach Eintritt der Menopause begannen, eine geringere Mortalität insgesamt (RR 0,70; 95%-KI 0,52–0,95, „moderate quality evidence“) und weniger koronare Herzerkrankungen (umfasst Todesfälle mit kardiovaskulären Ursachen und nicht tödliche Myokardinfarkte) (RR 0,52; 95%-KI 0,29–0,96; „moderate quality evidence“) aufwiesen. Allerdings zeigte sich weiterhin ein erhöhtes Risiko für venöse Thromboembolien (RR 1,74; 95%-KI 1,11–2,73, „high quality evidence“), verglichen mit Placebo oder Frauen ohne Behandlung. Ein erhöhtes Risiko für Schlaganfälle scheint nicht vorzuliegen.
In einer 2016 publizierten Studie von Savolainen-Peltonen et al.42 wurde eine Reduzierung der Mortalität aufgrund kardiovaskulärer Ereignisse bei HRT-Anwenderinnen beobachtet. Eine Risikoreduktion war sowohl bei frühem als auch spätem Beginn einer HRT zu beobachten. Wurde allerdings früh begonnen, war der protektive Effekt ausgeprägter. Aus diesem Grund gehen die Autoren von einer „Timing“-Hypothese aus. Danach ist das Risiko für kardiovaskuläre Herzerkrankungen umso geringer, je früher mit der Hormontherapie begonnen wird. Die gleiche Arbeitsgruppe untersuchte 2015 die kardiovaskuläre Mortalität und die Gesamtmortalität einer postmenopausalen Estrogen-basierten Hormontherapie in Abhängigkeit von der Anwendungsdauer einer HRT71. Sie stellten fest, dass die Gesamtmortalität bei Anwenderinnen einer HRT um 12–38 % reduziert war und diese Reduktion nahezu linear mit der Anwendungsdauer korrelierte. Laut den Autoren sollte die Behandlung von Hitzewallungen weiterhin die Hauptindikation für eine HRT sein, um jedoch den maximalen kardiovaskulären Nutzen daraus zu ziehen, sollte die Hormontherapie möglichst früh nach Eintritt der Menopause begonnen werden.
Transdermale versus orale Anwendung
In einer retrospektiven Studie von 2016 wurden die verschiedenen Anwendungsformen der Hormonersatztherapie im Hinblick auf das Risiko untersucht, Herz-Kreislauf-Erkrankungen zu erleiden72. Bei der Studie wurden Datenbankangaben verschiedener US-Krankenversicherungsgesellschaften von 1999 bis 2011 ausgewertet: 2.511 Frauen mit oraler Einnahme wurden ebenso vielen Frauen mit transdermaler Anwendung zugeordnet. Im Schnitt waren die Frauen 55 Jahre alt, durften keine Herz-Kreislauf-Erkrankungen in ihrer Vorgeschichte aufweisen und keine anderen Hormone einnehmen. Die Häufigkeit von neu auftretenden Herz-Kreislauf-Erkrankungen (inklusive venöse Thrombosen) war bei der transdermalen Hormonersatztherapie um 19 % geringer als bei der oralen Therapie (adjustierte Inzidenzraten-Ratio IRR 0,81; 95%-KI 0,67–0,99). Eine Subgruppenanalyse, die das Auftreten koronarer Herzerkrankung und Schlaganfall zusammen auswertete, ergab eine verringerte Inzidenz bei der transdermalen Anwendung (nicht signifikant, adjustierte IRR 0,85; 95%-KI 0,69–1,03). Auch die Inzidenz für venöse Thrombosen war geringer im Vergleich zu der oralen Therapie (adjustierte IRR 0,42; 95%-KI 0,19–0,96). Die Kosten für Arzneimittel sowie für ambulante und stationäre Betreuung zeigten sich bei der transdermalen Therapie niedriger (nicht signifikant) als bei der Einnahme oraler Präparate.
In einer Metaanalyse wurden die Ergebnisse von 15 Beobachtungsstudien zusammengetragen, in denen die orale und transdermale Anwendung von Estrogenen bezüglich kardiovaskulärer Endpunkte analysiert wurden27. Dabei wurde herausgestellt, dass die orale Estrogen-Therapie im Vergleich zur transdermalen Anwendung mit einem erhöhten Risiko für venöse Thromboembolien (VTE) (RR 1,63; 95%-KI 1,40–1,90), tiefe Venenthrombose (DVT) (RR 2,09; 95%-KI 1,35–3,23) und möglicherweise auch Schlaganfall (RR 1,24; 95%-KI 1,03–1,48) assoziiert ist, nicht jedoch mit einer Erhöhung des Risikos für Myokardinfarkt (RR 1,17; 95%-KI 0,80–1,71). Die Ergebnisse zum Schlaganfall basierten lediglich auf einer Fall-Kontrollstudie 39, die jedoch inzwischen durch zwei weitere nicht interventionelle Studien bestätigt wurden40,41.
-
Statistisches Bundesamt. (Sep 2017). DESTATIS. Abgerufen am 26. Sep 2017 von www.destatis.de/DE/ZahlenFakten/GesellschaftStaat/Gesundheit/Todesursachen/Todesursachen.html
-
Mosca, L., et al. (2007, Mar). Evidence-based guidelines for cardiovascular disease prevention in women: 2007 update. Circulation, 115(11), pp. 1481-501.
-
Mendelsohn, M., & Karas, R. (2005, Jun). Molecular and cellular basis of cardiovascular gender differences. Science, 308(5728), pp. 1583-7.
-
Shufelt, C., et al. (2016, Feb). Carotid artery distensibility and hormone therapy and menopause: the Los Angeles Atherosclerosis Study. Menopause, 23(2), pp. 150-7.
-
Phillips, L., & Langer, R. (2005, Mar). Postmenopausal hormone therapy: critical reappraisal and a unified hypothesis. Fertil Steril, 83(3), pp. 558-66.
-
Mikkola, T., Savolainen-Peltonen, H., Venetkoski, M., & Ylikorkala, O. (2017, Feb). New evidence for cardiac benefit of postmenopausal hormone therapy. Climacteric, 20(1), pp. 5-10.
-
Mendelsohn, M., & Karas, R. (1999). The protective effects of estrogen on the cardiovascular system. N Engl J Med, 340, pp. 1801-11.
-
Dimitrova, KR, et al. (2002, Feb). Estrogen and homocysteine. Cardiovasc Res. Vol. 53, 3, pp. 577-88. Gynäkologie, Menopause.
-
Menazza, S and Murphy, E. (2016, Mar). The Expanding Complexity of Estrogen Receptor Signaling in the Cardiovascular System. Circ Res. Vol. 118, 6, pp. 994-1007. Gynäkologie.
-
Craven, T., et al. (1990, Oct). Evaluation of the associations between carotid artery atherosclerosis and coronary artery stenosis. A case-control study. Circulation, 82(4), pp. 1230-42.
-
Salonen, J., & Salonen, R. (1991, Sep-Oct). ltrasonographically assessed carotid morphology and the risk of coronary heart disease. Arterioscler Thromb, 11(5), pp. 1245-9.
-
Hodis, H., Mack, W., LaBree, L., Selzer, R., Liu, C., Liu, C., & Azen, S. (1998, Feb). The role of carotid intima-media thickness in predicting clinical coronary events. Ann Intern Med, 128(4), pp. 262-9.
-
Tremollieres, FA, et al. (2000, Nov). Effect of hormone replacement therapy on age-related increase in carotid artery intima-media thickness in postmenopausal women. Atherosclerosis. Vol. 153, 1, pp. 81-8. Gynäkologie, Menopause.
-
Harman, S., et al. (2014, Aug). Arterial imaging outcomes and cardiovascular risk factors in recently menopausal women: a randomized trial. Ann Intern Med, 161(4), pp. 249-60.
-
Hodis, H., et al. (2016, Mar). Vascular Effects of Early versus Late Postmenopausal Treatment with Estradiol. N Engl J Med, 374(13), pp. 1221-31.
-
Muka, T., et al. (2016, Jun). Association of Vasomotor and Other Menopausal Symptoms with Risk of Cardiovascular Disease: A Systematic Review and Meta-Analysis. PLoS One, 11(6), p. e0157417.
-
Hulley, S., et al. (1998, Aug). Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. JAMA, 280(7), pp. 605-13.
-
Manson, J., et al. (2003, Aug). Estrogen plus progestin and the risk of coronary heart disease. N Engl J Med, 349(6), pp. 523-34.
-
Rossouw, J., et al. (2007, Apr). Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA, 297(13), pp. 1465-77.
-
Manson, J., et al. (2013, Oct). Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women's Health Initiative randomized trials. JAMA, 310(13), pp. 1353-68.
-
Grodstein, F., Manson, J., & Stampfer, M. (2006, Jan-Feb). Hormone therapy and coronary heart disease: the role of time since menopause and age at hormone initiation. J Womens Health (Larchmt), 15(1), pp. 35-44.
-
Løkkegaard, E., Andreasen, A., Jacobsen, R., & Nielsen, L. A. (Nov 2008). Hormone therapy and risk of myocardial infarction: a national register study. Eur Heart J, 29(21), S. 2660-8.
-
Gold, E., et al. (2000). Relation of demographic and lifestyle factors to symptoms in a multi-racial/ethnic population of women 40-55 years of age. Am J Epidemiol, 152(5), pp. 463-73.
-
Chilvers, CE, et al., et al. (2003, Dec). Post menopausal hormone replacement therapy and risk of acute myocardial infarction--a case control study of women in the East Midlands, UK. Eur Heart J. Vol. 24, 24, pp. 2197-205. Gynäkologie, Menopause.
-
Hippisley-Cox, J, et al., (2003, Mar). A case-control study on the effect of hormone replacement therapy on ischaemic heart disease. Br J Gen Pract. Vol. 53, 488, pp. 191-6. Gynäkologie, Menopause.
-
de Vries, CS, Bromley, SE and Farmer, RD. (2006, Feb). Myocardial infarction risk and hormone replacement: differences between products. Maturitas. Vol. 53, 3, pp. 343-50. Gynäkologie, Menopause.
-
Mohammed, K., et al. (2015, Nov). Oral vs Transdermal Estrogen Therapy and Vascular Events: A Systematic Review and Meta-Analysis. J Clin Endocrinol Metab, 100(11), pp. 4012-20.
-
Hendrix, S., et al. (2006, May). Effects of conjugated equine estrogen on stroke in the Women's Health Initiative. Circulation, 113(20), pp. 2425-34.
-
Wassertheil-Smoller, S., et al. (2003, May). Effect of estrogen plus progestin on stroke in postmenopausal women: the Women‘s Health Initiative: a randomized trial. JAMA, 289(20), pp. 2673-84.
-
Schierbeck, L., et al. (2012, Oct). Effect of hormone replacement therapy on cardiovascular events in recently postmenopausal women: randomised trial. BMJ, 345, p. e6409.
-
Boardman, H., et al. (2015, Mar). Hormone therapy for preventing cardiovascular disease in post-menopausal women. Cochrane Database Syst Rev(3), p. CD002229.
-
Prentice, RL, et al., (2005, Sep). Combined postmenopausal hormone therapy and cardiovascular disease: toward resolving the discrepancy between observational studies and the Women's Health Initiative clinical trial. Am J Epidemiol. Sep 2005, Vol. 162, 5, pp. 404-14. Gynäkologie, Menopause.
-
Arana, A, et al., (2006, Sep-Oct). Hormone therapy and cerebrovascular events: a population-based nested case-control study. Menopause. Sep-Oct 2006, Vol. 13, 5, pp. 730-6. Gynäkologie, Menopause.
-
Canonico, M., et al. (2007, Feb). Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study. Circulation, 115(7), pp. 840-5.
-
Lobo, RA. (2009). The risk of stroke in postmenopausal women receiving hormonal therapy. Vol. 12, Suppl 1, pp. 81-5. Gynäkologie, Menopause.
-
Lisabeth, L and Bushnell, C. (2012, Jan). Stroke risk in women: the role of menopause and hormone therapy. Lancet Neurol. Vol. 11, 1, pp. 82-91. Gynäkologie, Menopause.
-
Tuomikoski, P, et al., (2015, Jul). The risk of fatal stroke in Finnish postmenopausal hormone therapy users before and after the Women's Health Initiative: A cohort study. Maturitas. Vol. 81, 3, pp. 384-8. Gynäkologie, Menopause.
-
Grodstein, F, et al., (2008, Apr). Postmenopausal hormone therapy and stroke: role of time since menopause and age at initiation of hormone therapy. Arch Intern Med. Vol. 168, 8, pp. 861-6. Gynäkologie, Menopause.
-
Renoux, C., Dell'aniello, S., Garbe, E., Suissa, S. (2010, Jun). Transdermal and oral hormone replacement therapy and the risk of stroke: a nested case-control study. BMJ, 340, p. c2519.
-
Canonico, M., et al. (2016, Jul). Postmenopausal Hormone Therapy and Risk of Stroke: Impact of the Route of Estrogen Administration and Type of Progestogen. Stroke, 47(7), pp. 1734-41.
-
Løkkegaard, E., Nielsen, L., & Keiding, N. (2017, Aug). Risk of Stroke With Various Types of Menopausal Hormone Therapies: A National Cohort Study. Stroke, 48(8), pp. 2266-9.
-
Savolainen-Peltonen, H, et al., (2016, Jul). Cardiac Death Risk in Relation to the Age at Initiation or the Progestin Component of Hormone Therapies. J Clin Endocrinol Metab. Vol. 101, 7, pp. 2794-801.
-
Grady, D., et al. (2000, May). Postmenopausal hormone therapy increases risk for venous thromboembolic disease. The Heart and Estrogen/progestin Replacement Study. Ann Intern Med, 132(9), pp. 689-96.
-
Cushman, M., et al. (2004, Oct). Estrogen plus progestin and risk of venous thrombosis. JAMA, 292(13), pp. 1573-80.
-
Curb, J., et al. (2006, Apr). Venous thrombosis and conjugated equine estrogen in women without a uterus. Arch Intern Med, 166(7), pp. 772-80.
-
Rossouw JE, et al. (2002). Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women's Health Initiative randomized controlled trial. JAMA ;288(3):321-333.
-
LaCroix, A. (2005, Mar 21-23). Estrogen with and without progestin: benefits and risks of short-term use. NIH State-of-the-Science Conference on management of menopause-related symptoms. Final Panel Statement, 73-9. Bethesda, Maryland.
-
Kroon, U., Silfverstolpe, G., & Tengborn, L. (1994, Apr). The effects of transdermal estradiol and oral conjugated estrogens on haemostasis variables. Thromb Haemost, 71(4), pp. 420-3.
-
Scarabin, P., et al. (1997, Nov). Effects of oral and transdermal estrogen/progesterone regimens on blood coagulation and fibrinolysis in postmenopausal women. A randomized controlled trial. Arterioscler Thromb Vasc Biol, 17(11), pp. 3071-8.
-
Vehkavaara, S., et al. (2001, Apr). Effects of oral and transdermal estrogen replacement therapy on markers of coagulation, fibrinolysis, inflammation and serum lipids and lipoproteins in postmenopausal women. Thromb Haemost, 85(4), pp. 619-25.
-
Oger, E., et al. (2003, Sep). Differential effects of oral and transdermal estrogen/progesterone regimens on sensitivity to activated protein C among postmenopausal women: a randomized trial. Arterioscler Thromb Vasc Biol, 23(9), pp. 1671-6.
-
Conard, J., Samama, M., Basdevant, A., Guy-Grand, B., & de Lignières, B. (1983, Jun). Differential AT III-response to oral and parenteral administration of 17 beta-estradiol. Thromb Haemost, 49(3), p. 252.
-
Post, M., et al. (2003, Jun). Effect of oral and transdermal estrogen replacement therapy on hemostatic variables associated with venous thrombosis: a randomized, placebo-controlled study in postmenopausal women. Arterioscler Thromb Vasc Biol, 23(6), pp. 1116-21.
-
Heiss, G., et al. (2008, Mar). Health risks and benefits 3 years after stopping randomized treatment with estrogen and progestin. JAMA, 299(9), pp. 1036-45.
-
Sweetland, S., et al. (2012). Venous thromboembolism risk in relation to use of different types of postmenopausal hormone therapy in a large prospective study. J Thromb Haemost, 10(11), pp. 2277-86.
-
Høibraaten, E, et al., (2000, Dec). Increased risk of recurrent venous thromboembolism during hormone replacement therapy--results of the randomized, double-blind, placebo-controlled estrogen in venous thromboembolism trial (EVTET). Thromb Haemost. Dec 2000, Vol. 84, 6, pp. 961-7. Gynäkologie, Menopause.
-
Herrington, DM, et al., (2002, Jun). Factor V Leiden, hormone replacement therapy, and risk of venous thromboembolic events in women with coronary disease. Arterioscler Thromb Vasc Biol. Vol. 22, 6, pp. 1012-7. Gynäkologie, Menpause.
-
Speroff, L. (2010, Oct). Transdermal hormone therapy and the risk of stroke and venous thrombosis. Climacteric. Vol. 13, 5, pp. 429-32. Gynäkologie, Menopause.
-
Smith, N., et al. (2014, Jan). Lower risk of cardiovascular events in postmenopausal women taking oral estradiol compared with oral conjugated equine estrogens. JAMA Intern Med, 174(1), pp. 25-31.
-
Scarabin, P., Oger, E., Plu-Bureau, G., & Group, E. a. (2003, Aug). Differential association of oral and transdermal oestrogen-replacement therapy with venous thromboembolism risk. Lancet, 362(9382), pp. 428-32.
-
Renoux, C., Dell'Aniello, Suissa, S. (2010, May). Hormone replacement therapy and the risk of venous thromboembolism: a population-based study. J Thromb Haemost, 8(5), pp. 979-86.
-
Roach, R., et al. (2013). The risk of venous thrombosis in women over 50 years old using oral contraception or postmenopausal hormone therapy. J Thromb Haemost, 11(1), pp. 124-31.
-
Bergendal, A., Kieler, H., Sundström, A., Hirschberg, A., & Kocoska-Maras, L. (2016, Jun). Risk of venous thromboembolism associated with local and systemic use of hormone therapy in peri- and postmenopausal women and in relation to type and route of administration. Menopause: The Journal of The North American Menopause Society, 23(6), pp. 593-9.
-
Canonico, M., et al. (2010, Feb). Postmenopausal hormone therapy and risk of idiopathic venous thromboembolism: results from the E3N cohort study. Arterioscler Thromb Vasc Biol, 30(2), pp. 340-5.
-
Straczek, C., et al. (2005, Nov). Prothrombotic mutations, hormone therapy, and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration. Circulation, 112(22), pp. 3495-500.
-
Canonico, M., et al. (2006, Jun). Obesity and risk of venous thromboembolism among postmenopausal women: differential impact of hormone therapy by route of estrogen administration. The ESTHER Study. J Thromb Haemost, 4(6), pp. 1259-65.
-
American College of Obstetricians and Gynecologists. (2013, Apr). ACOG committee opinion no. 556: Postmenopausal estrogen therapy: route of administration and risk of venous thromboembolism. Obstet Gynecol, 121(4), pp. 887-90.
-
Baber, R., Panay, N., Fenton, A., & for the IMS Writing Group. (2016). IMS Recommendations on women's midlife health and menopause hormone therapy. Climacteric, 19(2), pp. 109-50.
-
NAMS (The North American Menopause Society). (2017, Jun). The 2017 hormone therapy position statement of The North American Menopause Society. Menopause: The Journal of The North American Menopause Society, 24(7), pp. 728-53.
-
Hsia, J., et al. (2006, Feb). Conjugated equine estrogens and coronary heart disease: the Women's Health Initiative. Arch Intern Med, 166(3), pp. 357-65.
-
Mikkola, TS, et al., (2015, Sep). Estradiol-based postmenopausal hormone therapy and risk of cardiovascular and all-cause mortality. Menopause. Vol. 22, 9, pp. 976-83. Gynäkologie, Menopause.
-
Simon, et al., (2016, Jun). Venous thromboembolism and cardiovascular disease complications in menopausal women using transdermal versus oral estrogen therapy. Menopause: The Journal of The North American Menopause Society, 23(6), pp. 600-10.