HRT und Brustkrebsrisiko
Brustkrebs ist die weltweit häufigste maligne Tumorart von Frauen1 und manifestiert sich insbesondere im Bereich der Wechseljahre. In Deutschland starben 2015 959 Frauen im Alter von 40 bis unter 50 Jahre an bösartigen Neubildungen der Brustdrüse. Bei den 50 bis unter 60 Jahre alten Frauen waren es bereits 2.285 Frauen2.
Brustkrebsrisiko bei Anwendung einer Hormontherapie
Nach Geschlecht und Alter sind genetische und hormonelle Faktoren von erheblichem Einfluss auf das Brustkrebsrisiko. Das körpereigene Estradiol in der Postmenopause ist als Risikofaktor für Brustkrebs etabliert3, während keine Beziehung zwischen den sehr geringen postmenopausalen Blutspiegeln an endogenem Progesteron (0,015–0,105 ng/ml, Medianwert 0,04 ng/ml) und dem Brustkrebsrisiko festgestellt wurde4. Bei prämenopausalen Frauen scheinen die Blutspiegel an endogenem Progesteron sogar in umgekehrter Beziehung zum Brustkrebsrisiko zu stehen5,6.
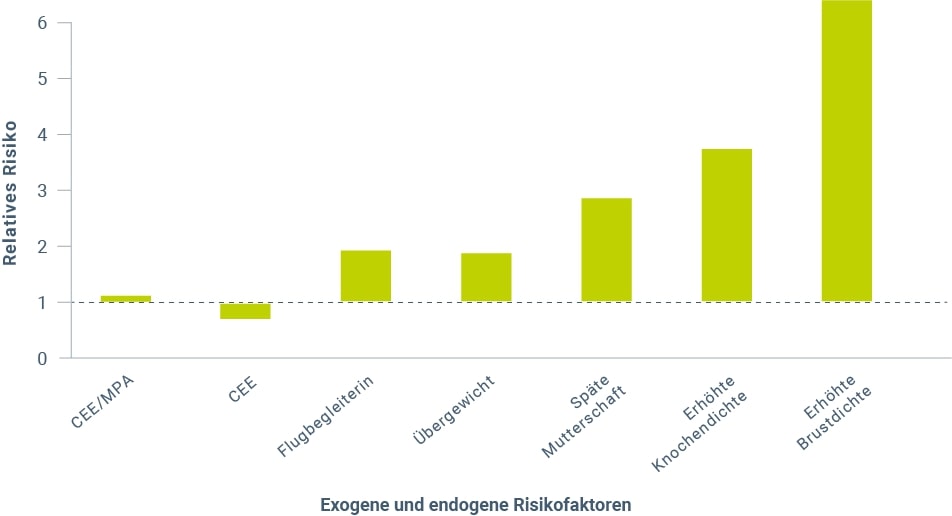
Für die Hormontherapie nach der Menopause deuten die Befunde der WHI-Studie7,8 und epidemiologischer Untersuchungen9,10,11,12 darauf hin, dass Estrogen-Gestagen-Kombinationen mit einer stärkeren Erhöhung des Brustkrebsrisikos einhergehen im Vergleich zur alleinigen Estrogenanwendung13,14,15,16,17,18. Im Vergleich mit anderen exogenen und endogenen Faktoren ist jedoch die Risikosteigerung durch eine HRT minimal (Abb. 1)19. Das in der WHI-Studie beobachtete Risiko für Brustkrebs lag bei Frauen (Durchschnittsalter 63 Jahre), die randomisiert konjugierte Stutenestrogene (CEE) und Medroxyprogesteronacetat (MPA) erhielten, bei weniger als einer zusätzlichen Brustkrebserkrankung pro 1.000 Anwenderinnen20. Dieses Risiko ist kaum höher als es für Frauen beobachtet wurde, die täglich ein Glas Wein zu sich nehmen und sogar geringer als bei Frauen, die zwei Gläser Wein täglich trinken. Es ist außerdem ähnlich dem Risiko, das bei Übergewicht, geringer körperlicher Aktivität und anderen Medikamenten beschrieben wird21.
Ein erhöhtes Brustkrebsrisiko entwickelt sich im Laufe einer längerfristigen Therapie nach einigen Jahren und bildet sich offenbar nach Therapieende über die Zeit wieder zurück oder stagniert9,11,20,22,47. Neuere Analysen der Kohortenstudie E3N zeigten allerdings im Gegensatz dazu ein länger anhaltendes erhöhtes Risiko bei einer Langzeitanwendung von über 5 Jahren und dem Einsatz von synthetischen Gestagenen23.
Abbildung 1: Brustkrebsrisiko. Einfluss verschiedener Faktoren auf das relative Risiko, an Brustkrebs zu erkranken (modifiziert nach Lobo 201719). CEE = konjugierte Stutenestrogene; MPA = Medroxyprogesteronacetat.
Estrogen-Monotherapie
Eine Reihe von Studienergebnissen legt nahe, dass die Anwendung von Estrogenen alleine im Vergleich zur Anwendung von Estrogen-Gestagen-Kombinationen mit keinem oder sogar einem geringeren Risiko an Brustkrebs-Diagnosen verbunden ist16,17,18,24. Dies ergibt sich insbesondere aus der WHI-Studie, wo sich zwar für die Kombination von CEE und MPA mit zunehmender Anwendungsdauer ein erhöhtes Brustkrebsrisiko zeigte, unter Estrogen-Monotherapie jedoch über einen Zeitraum von 7,2 Jahren 7 weniger Brustkrebsfälle pro 10.000 Frauenjahren auffielen als unter Placebo (HR 0,79; 95%-KI 0,61–1,02)7,8,20,25. Keinen Unterschied scheint es hierbei zu machen, ob konjugierte Stutenestrogene oder Estradiol verwendet werden26.
Allerdings liegen keine randomisiert kontrollierten Studien vor, die aufgrund des Designs oder der nötigen Power Rückschlüsse auf eine Langzeittherapie mit einer Estrogen-Monotherapie im Hinblick auf das Brustkrebsrisiko zulassen. Eine kleine, randomisierte, nicht verblindete Studie konnte kein erhöhtes Brustkrebsrisiko bei einer HRT-Anwendung bis zu 10 Jahre und auch nicht im Rahmen des Follow-ups nach 16 Jahren beobachten. Dies war allerdings nicht das vorrangige Untersuchungsziel27. Die Ergebnisse von lang andauernden Beobachtungsstudien zeigen sich unterschiedlich: einige Beobachtungsstudien und Metaanalysen legten ein erhöhtes Brustkrebsrisiko bei mehr als 5 Jahre Estrogenanwendung dar9,28, andere nicht29,30,31,32,33,34.
Estrogen-Gestagen-Kombinationstherapie und die Wahl des Gestagens
In der WHI-Studie wurde ein erhöhtes Risiko für Brustkrebs mit neun zusätzlichen Fällen pro 10.000 Frauenjahren (HR 1,24, 95%-KI 1,01–1,53) in einem Behandlungszeitraum von 5,6 Jahren festgestellt20. Ob die Ergebnisse einer kontinuierlich-kombinierten Hormontherapie mit konjugierten Stutenestrogenen und MPA auf alle HRT-Regimes mit anderen Dosierungen und Wirkstoffen übertragen werden kann, ist fraglich35. Einige Studien haben zum Beispiel gezeigt, dass das Risiko bei einer kontinuierlichen Therapie höher als bei einer sequentiellen Verwendung ist18,24. Andere Untersuchungen haben jedoch keinen Unterschied in den beiden Anwendungsregimen gefunden17.
Bei einer Estrogen-Gestagen-Kombinationstherapie scheint es bezüglich des Brustkrebsrisikos sehr auf die Verwendung des entsprechenden Gestagens anzukommen: laut epidemiologischen Daten sind synthetische Gestagene mit einem höheren Risiko für Brustkrebs verbunden als mikronisiertes Progesteron18,23,36. Murkes et al. 201137 und Murkes et al. 201238 zeigten eine höhere Proliferation der Brustzellen bei der Verwendung von oral verabreichten konjugierten Stutenestrogenen in Kombination mit MPA als bei der Verwendung von transdermalem Estradiol mit oralem mikronisiertem Progesteron.
In einer französischen Kohortenstudie39, die den Einfluss einer Langzeitanwendung einer Hormonersatztherapie auf die Brustkrebsinzidenz untersuchte, wurde keine Erhöhung des Brustkrebsrisikos durch die Hormonsubstitution festgestellt. Dies galt auch für eine langfristige Anwendung über 10 Jahre hinaus. Im Gegensatz zu den Vereinigten Staaten spielen in Frankreich jedoch konjugierte Estrogene und MPA keine nennenswerte Rolle in der Hormonersatztherapie. Vielmehr dominieren dort Kombinationen aus transdermalem Estradiol und Progesteron-ähnlichen Gestagenen oder mikronisiertem Progesteron. In der vorliegenden monozentrischen Studie dominierte transdermales Estradiol-Gel (83 % der Anwenderinnen) und als Gestagen orales mikronisiertes Progesteron (58 % der Anwenderinnen). In der gesamten Kohorte, die 1.739 Frauen einschloss, entwickelten 105 Frauen einen Brustkrebs während der Beobachtungszeit, die im Mittel 8,9 Jahre betrug. Dies entsprach einer Inzidenz von 37 Brustkrebsfällen pro 10.000 Frauen und Jahr. Die Zahl der anhand des französischen Krebsregisters erwarteten Brustkrebsfälle bei der Kohortengröße betrug dagegen 66. Nach Adjustierung der Daten, u. a. hinsichtlich Lebensalter und Alter bei Menopauseneintritt, betrug das relative Risiko (RR) unter einer Hormonsubstitution einen Brustkrebs zu entwickeln, 0,98 (95%-KI 0,65–1,5).
Bedeutsamer sind die Ergebnisse der französischen E3N-EPIC-Kohortenstudie40. In dieser Studie mit insgesamt fast 100.000 Frauen ergab sich eine signifikante Erhöhung des Brustkrebsrisikos nur für die (zusammengefasste) Gruppe der Frauen, die orale oder transdermale Estrogene gemeinsam mit synthetischen Gestagenen (Substanzen mit Progesteron-ähnlicher Wirkung, aber abgewandelter Molekülstruktur) anwendeten (RR 1,69). Andererseits war das Brustkrebsrisiko für Anwenderinnen von Estrogenen in Kombination mit Progesteron (RR 1,0) nicht erhöht, wenngleich sich ein Trend zu einem (nicht signifikanten) Risikoanstieg mit zunehmender Anwendungsdauer zeigte.
Eine aktuellere E3N-Analyse, die sich speziell mit dem Brustkrebsrisiko nach Beendigung einer HRT befasst, bestätigt dabei Unterschiede je nach Art des für die HRT verwendeten Gestagens, wobei in dieser Untersuchung die HRT mit Progesteron und Dydrogesteron zusammengefasst und der HRT mit anderen Gestagenen beziehungsweise der alleinigen Estrogenanwendung gegenübergestellt wurde23. Hinsichtlich des Untersuchungsziels wurde bestätigt, dass Unterschiede zwischen einer HRT mit Progesteron/Dydrogesteron im Vergleich zu einer HRT mit anderen Gestagenen bestehen. Während für eine HRT mit anderen Gestagenen ein erhöhtes Brustkrebsrisiko auch für Jahre nach Behandlungsende weiterbestand, war eine HRT mit Progesteron/Dydrogesteron nicht mit einem erhöhten Brustkrebsrisiko nach Behandlungsende verbunden. Analog zu dem oben genannten Zeittrend in der Analyse von 2008 fiel eine Risikoerhöhung nach Anwendung einer HRT mit Progesteron/Dydrogesteron über einen Zeitraum > 5 Jahre auf, die jedoch im Ausmaß geringer war im Vergleich zu einer HRT mit anderen Gestagenen.
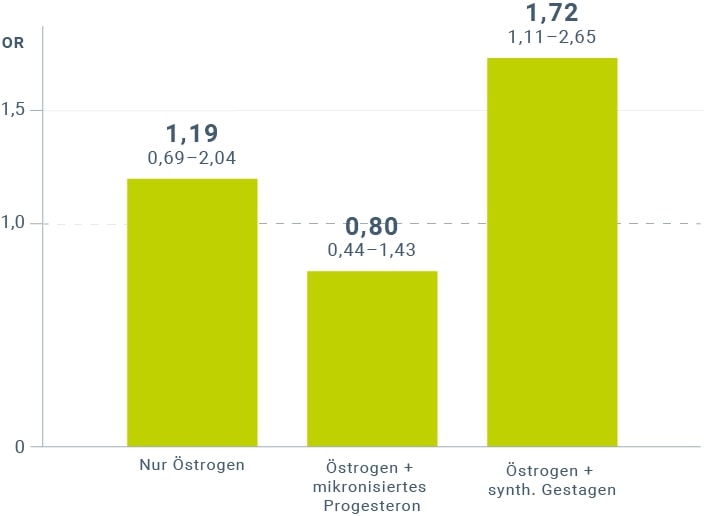
In einer französischen Fall-Kontroll-Studie (CECILE)41 mit 1.555 postmenopausalen Frauen, davon 739 Brustkrebspatientinnen (invasives oder in situ Karzinom) und 816 Kontrollen, fand sich in allen durchgeführten Analysen keine Erhöhung des Brustkrebsrisikos für Estrogene plus mikronisiertes Progesteron (OR 0,80, 95%-KI 0,44–1,43), während eine Risikosteigerung unter der Anwendung von Kombinationen aus Estrogenen und synthetischen Gestagenen bestätigt wurde (OR 1,72; 95%-KI 1,11–2,65) (Abb. 2). Eine Risikoerhöhung bei kombinierter HRT mit synthetischen Gestagenen wurde allerdings erst nach längerer Anwendung beobachtet: ≤ 4 Jahre OR 1,02; 95%-KI 0,4–2,58; ≥ 4 Jahre OR 1,92; 95%-KI 1,13–3,27.
Abbildung 2: Darstellung des Brustkrebsrisikos (Odds Ratio mit Grenzen des 95%-KI) bei verschiedenen Therapieregimen und unterschiedlichen Gestagenen (modifiziert nach Cordina-Duverger et al. 201341).
Applikationsform
Die Applikationsroute des Estrogens scheint das Brustkrebsrisiko nicht wesentlich zu beeinflussen13,32,34. Vorteilhaft zeigt sich die transdermale Anwendung von Estrogenen im Vergleich zur oralen vielmehr in Bezug auf das arterielle42,43,44 und venöse Thromboserisiko45,46.
Anwendung einer HRT bei Patientinnen mit Brustkrebs
Frauen mit überstandenem Brustkrebs sollten generell keine systemische Hormontherapie anwenden. Auch die lokale Hormontherapie stellt eine Kontraindikation dar. Laut den Empfehlungen der Nordamerikanischen Menopausegesellschaft und den Empfehlungen deutscher Fachgesellschaften kann allerdings nach Rücksprache mit einem Onkologen und wenn keine der nicht hormonellen Therapien anschlägt, eine vaginale Behandlung mit geringen Dosen in Betracht gezogen werden21,46.
-
McPherson, K., Steel, C., & Dixon, J. (1994, Oct). ABC of breast diseases. Breast cancer – epidemiology, risk factors and genetics. BMJ, 309(6960), pp. 1003-6.
-
Statistisches Bundesamt. (Sep 2017). DESTATIS. Abgerufen am 26. Sep 2017 von www.destatis.de/DE/ZahlenFakten/GesellschaftStaat/Gesundheit/Todesursachen/Todesursachen.html
-
Key, T., Appleby, P., Barnes, I., Reeves, G., & Group, E. H. (2002, Apr). Endogenous sex hormones and breast cancer in postmenopausal women: reanalysis of nine prospective studies. J Natl Cancer Inst, 94(8), pp. 606-16.
-
Missmer, SA., Eliassen, AH., Barbieri, RL., Hankinson. SE. (2004). Endogenous estrogen, androgen, and progesterone concentrations and breast cancer risk among postmenopausal women. J Natl Cancer Inst. 96. pp. 1856-65.
-
Micheli, A., et al. (2004, Nov). Endogenous sex hormones and subsequent breast cancer in premenopausal women. Int J Cancer, 112(2), pp. 312-8.
-
Kaaks, R., et al. (2005, May). Serum sex steroids in premenopausal women and breast cancer risk within the European Prospective Investigation into Cancer and Nutrition (EPIC). J Natl Cancer Inst, 97(10), pp. 755-65.
-
Chlebowski, R., et al. (2003, Jun). Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: the Women's Health Initiative Randomized Trial. JAMA, 289(24), pp. 3243-53.
-
Stefanick, M., et al. (2006, Apr). Effects of conjugated equine estrogens on breast cancer and mammography screening in postmenopausal women with hysterectomy. JAMA, 295(14), pp. 1647-57.
-
Beral, V., & Collaborators, M. W. (2003, Aug). Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet, 362(9382), pp. 419-27.
-
Reeves, G., et al. (2006, Nov). Hormonal therapy for menopause and breast-cancer risk by histological type: a cohort study and meta-analysis. Lancet Oncol, 7(11), pp. 910-8.
-
Flesch-Janys, D., et al. (2008, Aug). Risk of different histological types of postmenopausal breast cancer by type and regimen of menopausal hormone therapy. Int J Cancer, 123(4), pp. 933-41.
-
Jick, S., Hagberg, K., Kaye, J., & Jick, H. (2009, Jan). Postmenopausal estrogen-containing hormone therapy and the risk of breast cancer. Obstet Gynecol, 113(1), pp. 74-80.
-
Collins, J., Blake, J., & Crosignani, P. (2005, Nov-Dec). Breast cancer risk with postmenopausal hormonal treatment. Hum Reprod Update, 11(6), pp. 545-60.
-
Shah, N., Borenstein, J., & Dubois, R. (2005, Nov-Dec). Postmenopausal hormone therapy and breast cancer: a systematic review and meta-analysis. Menopause, 12(6), pp. 668-78.
-
Greiser, C., Greiser, E., & Dören, M. (2005, Nov-Dec). Menopausal hormone therapy and risk of breast cancer: a meta-analysis of epidemiological studies and randomized controlled trials. Hum Reprod Update, 11(6), pp. 561-73.
-
Benkhadra, K., et al. (2015, Nov). Menopausal Hormone Therapy and Mortality: A Systematic Review and Meta-Analysis. J Clin Endocrinol Metab, 100(11), pp. 4021-8.
-
Jones, M., et al. (2016, Aug). Menopausal hormone therapy and breast cancer: what is the true size of the increased risk? Br J Cancer, 115(5), pp. 607-15.
-
Yang, Z., et al. (2017, Feb). Estradiol therapy and breast cancer risk in perimenopausal and postmenopausal women: a systematic review and meta-analysis. Gynecol Endocrinol, 33(2), pp. 87-92.
-
Lobo, R. (2017, Apr). Hormone-replacement therapy: current thinking. Nat Rev Endocrinol, 13(4), pp. 220-31.
-
Manson, J., et al. (2013, Oct). Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women's Health Initiative randomized trials. JAMA, 310(13), pp. 1353-68.
-
NAMS (The North American Menopause Society). (2017, Jun). The 2017 hormone therapy position statement of The North American Menopause Society. Menopause: The Journal of The North American Menopause Society, 24(7), pp. 728-53.
-
Collaborative Group on Hormonal Factors in Breast Cancer. (1997, Oct). Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52,705 women with breast cancer and 108,411 women without breast cancer. Collaborative Group on Hormonal Factors in Breast Cancer. Lancet, 350(9084), pp. 1047-59.
-
Fournier, A., et al. (2014, Jun). Risk of breast cancer after stopping menopausal hormone therapy in the E3N cohort. Breast Cancer Res Treat, 145(2), pp. 535-43.
-
Lambrinoudaki, I. (2014, Apr). Progestogens in postmenopausal hormone therapy and the risk of breast cancer. Maturitas, 77(4), pp. 311-7.
-
Anderson, G., et al. (2006, Sep). Prior hormone therapy and breast cancer risk in the Women's Health Initiative randomized trial of estrogen plus progestin. Maturitas, 55(2), pp. 103-15.
-
Marsden, J. (2016). NICE guideline – Menopause: diagnosis and management Long-term benefits and risks of HRT (Section 11): Breast cancer. Post Reproductive Health, 22(2), pp. 85-91.
-
Schierbeck, L., et al. (2012, Oct). Effect of hormone replacement therapy on cardiovascular events in recently postmenopausal women: randomised trial. BMJ, 345, p. e6409.
-
Brinton, LA, et al. (2008, Nov.). Menopausal hormone therapy and breast cancer risk in the NIH-AARP Diet and Health Study Cohort. Cancer Epidemiol Biomarkers Prev. Vol. 17, 11, pp. 3150-60. Gynäkologie, Menopause.
-
Schairer, C, et al. (2000, Jan). Menopausal estrogen and estrogen-progestin replacement therapy and breast cancer risk. JAMA. Vol. 283, 4, pp. 485-91. Gynäkologie, Menopause.
-
Kerlikowske, K, et al. (2003, Dec). Prognostic characteristics of breast cancer among postmenopausal hormone users in a screened population. J Clin Oncol. Vol. 21, 23, pp. 4314-21. Gynäkologie, Menopause.
-
Chen, WY, et al. (2006, May). Unopposed estrogen therapy and the risk of invasive breast cancer. Arch Intern Med. Vol. 166, 9, pp. 1027-32. Gynäkologie, Menopause.
-
Lyytinen, H., Pukkala, E., & Ylikorkala, O. (2006, Dec). Breast cancer risk in postmenopausal women using estrogen-only therapy. Obstet Gynecol, 108(6), pp. 1354-60.
-
Prentice, RL, et al. (2009, Jul). Benefits and risks of postmenopausal hormone therapy when it is initiated soon after menopause. Am J Epidemiol. Vol. 170, 1, pp. 12-23. Gynäkologie, Menopause.
-
Bakken, K., et al. (2011, Jan). Menopausal hormone therapy and breast cancer risk: impact of different treatments. The European Prospective Investigation into Cancer and Nutrition. Int J Cancer, 128(1), pp. 144-56.
-
Simon, JA. (2014, Jul). What if the Women's Health Initiative had used transdermal estradiol and oral progesterone instead? Menopause. Vol. 21, 7, pp. 769-83. Gynäkologie, Menopause.
-
Asi, N., et al. (2016, Jul). Progesterone vs. synthetic progestins and the risk of breast cancer: a systematic review and meta-analysis. Syst Rev, 5(1), p. 121.
-
Murkes, D., et al. (2011, Mar). Effects of percutaneous estradiol-oral progesterone versus oral conjugated equine estrogens-medroxyprogesterone acetate on breast cell proliferation and bcl-2 protein in healthy women. Fertil Steril, 95(3), pp. 1188-91.
-
Murkes, D., et al. (2012, Oct). Percutaneous estradiol/oral micronized progesterone has less-adverse effects and different gene regulations than oral conjugated equine estrogens/medroxyprogesterone acetate in the breasts of healthy women in vivo. Gynecol Endocrinol, 28(Suppl 2), pp. 12-5.
-
De Lignières, B., et al. (2002, Dec). Combined hormone replacement therapy and risk of breast cancer in a French cohort study of 3175 women. Climacteric, 5(4), pp. 332-40.
-
Fournier, A., Berrino, F., & Clavel-Chapelon, F. (2008, Jan). Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study. Breast Cancer Res Treat, 107(1), pp. 103-11.
-
Cordina-Duverger, E., et al. (2013, Nov). Risk of breast cancer by type of menopausal hormone therapy: a case-control study among post-menopausal women in France. PLoS One, 8(11), p. e78016.
-
Løkkegaard, E., Andreasen, A., Jacobsen, R., & Nielsen, L. A. (Nov 2008). Hormone therapy and risk of myocardial infarction: a national register study. Eur Heart J, 29(21), S. 2660-8.
-
Renoux, C., Dell'aniello, S., Garbe, E., Suissa, S. (2010, Jun). Transdermal and oral hormone replacement therapy and the risk of stroke: a nested case-control study. BMJ, 340, p. c2519.
-
Canonico, M., et al. (2016, Jul). Postmenopausal Hormone Therapy and Risk of Stroke: Impact of the Route of Estrogen Administration and Type of Progestogen. Stroke, 47(7), pp. 1734-41.
-
Olié, V., Canonico, M., & Scarabin, P. (2010, Sep). Risk of venous thrombosis with oral versus transdermal estrogen therapy among postmenopausal women. Curr Opin Hematol, 17(5), pp. 457-63.
-
Mueck, AO, federführend für die AG Hormone des BVF. (2015). Anwendungsempfehlungen zur Hormonsubstitution in Klimakterium und Postmenopause: Aktualisierte gemeinsame Empfehlungen. Frauenarzt, 56(8), S. 657-60.
-
Chlebowski, R., et al. (2009, Feb). Breast cancer after use of estrogen plus progestin in postmenopausal women. N Engl J Med, 360(6), pp. 573-87.